网址:http://m.1010jiajiao.com/timu_id_400178[举报]
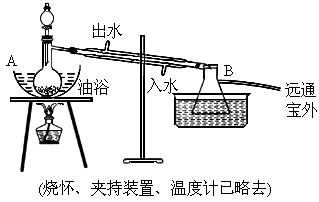
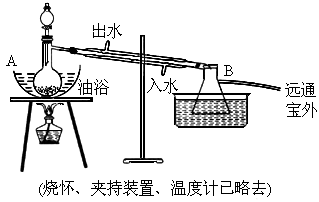
乙酸乙酯是无色具有水果香味的液体,沸点77.2℃,实验室某次制取它用冰醋酸14.3mL,95%乙醇23mL.还用到浓硫酸、饱和碳酸钠以及极易与乙醇结合成六水合物的氯化钙溶液.主要仪器如下图所示:
实验步骤是:
①先向A中蒸馏烧瓶注入少量乙醇和浓硫酸后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗里待用.这时分液漏斗里两种有物的物质的量比约为5∶7.
②加热油浴保温约135~145℃.
③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加料速度使蒸出酯的速度与进料速度大体相等,直到加料完成.
④保持油浴温度一段时间,至不再有液体液后,停止加热.
⑤取下B中的锥型瓶,将一定量饱和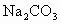 溶液分批少量多次地加到馏出液里,边加边摇荡,至无气泡产生为止.
溶液分批少量多次地加到馏出液里,边加边摇荡,至无气泡产生为止.
⑥将⑤的液混合物分液,弃取水层.
⑦用饱和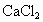 溶液(适量)加入到分液漏斗中,摇荡一段时间后静置,放出水层(废液).
溶液(适量)加入到分液漏斗中,摇荡一段时间后静置,放出水层(废液).
⑧分液漏斗里得到的是初步提的乙酸乙酯粗品.
试回答:
(1)实验中硫酸的主要作用是___________________________.
(2)用过量乙醇的主要目的是___________________________.
(3)用饱和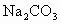 溶液洗涤粗酯的目的是___________________.如果用NaOH浓溶液代替
溶液洗涤粗酯的目的是___________________.如果用NaOH浓溶液代替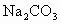 将引起的后果是_____________________.
将引起的后果是_____________________.
(4)用饱和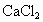 溶液洗涤粗酯的目的是__________________.
溶液洗涤粗酯的目的是__________________.
(5)为什么作③要使加料与馏出的速度大致相等?_________________.
(6)⑧所示的粗酯里还有的杂质是________________.
(7)B中锥型瓶为什么要长导管把蒸气送出室外?___________________.
查看习题详情和答案>>乙酸乙酯是无色具有水果香味的液体,沸点77.2℃,实验室某次制取它用冰醋酸14.3mL,95%乙醇23mL.还用到浓硫酸、饱和碳酸钠以及极易与乙醇结合成六水合物的氯化钙溶液.主要仪器如下图所示:
实验步骤是:
①先向A中蒸馏烧瓶注入少量乙醇和浓硫酸后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗里待用.这时分液漏斗里两种有物的物质的量比约为5∶7.
②加热油浴保温约135~145℃.
③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加料速度使蒸出酯的速度与进料速度大体相等,直到加料完成.
④保持油浴温度一段时间,至不再有液体液后,停止加热.
⑤取下B中的锥型瓶,将一定量饱和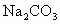 溶液分批少量多次地加到馏出液里,边加边摇荡,至无气泡产生为止.
溶液分批少量多次地加到馏出液里,边加边摇荡,至无气泡产生为止.
⑥将⑤的液混合物分液,弃取水层.
⑦用饱和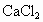 溶液(适量)加入到分液漏斗中,摇荡一段时间后静置,放出水层(废液).
溶液(适量)加入到分液漏斗中,摇荡一段时间后静置,放出水层(废液).
⑧分液漏斗里得到的是初步提的乙酸乙酯粗品.
试回答:
(1)实验中硫酸的主要作用是___________________________.
(2)用过量乙醇的主要目的是___________________________.
(3)用饱和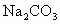 溶液洗涤粗酯的目的是___________________.如果用NaOH浓溶液代替
溶液洗涤粗酯的目的是___________________.如果用NaOH浓溶液代替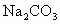 将引起的后果是_____________________.
将引起的后果是_____________________.
(4)用饱和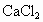 溶液洗涤粗酯的目的是__________________.
溶液洗涤粗酯的目的是__________________.
(5)为什么作③要使加料与馏出的速度大致相等?_________________.
(6)⑧所示的粗酯里还有的杂质是________________.
(7)B中锥型瓶为什么要长导管把蒸气送出室外?___________________.
查看习题详情和答案>>
a.冰醋酸14.3mL(约0.25mol),b.95%乙醇23mL(约0.37mol),c.浓H2SO4,d.饱和 Na2CO3溶液,e.饱和CaCl2溶液(CaCl2易跟乙醇生成CaCl2·6C2H5OH)。
实验过程主要是将各装置连接好并检查气密性后,进行以下各步骤:
①在蒸馏烧瓶里注入少量乙醇和所需全部浓 H2SO4并混合均匀。在分液漏斗里加入剩下的乙醇和全部冰醋酸并混合均匀。
②用油浴加热,温度保持在130℃~140℃。
③将分液漏斗内液体缓缓滴入蒸馏烧瓶。调节滴入液体速率,使之与馏出酯的滴液速率大致相同,直到加料完毕。
④温度保持一段时间,至没有液体馏出时,停止加热。
⑤取下锥形瓶B,将饱和Na2CO3溶液分批分次加到馏出液里,边加边摇荡至没有气泡产生时为止。
⑥将B中液体在另一分液漏斗中分液,弃去水层。
⑦在分液漏斗油层中加入饱和CaCl2溶液,摇荡后静置,分层分液,弃去水层。油层为粗制乙酸乙酯。
试回答:
(1)配料中的乙醇和乙酸未按物质的量比1∶1配制的理由是________。
(2)浓H2SO4的作用是________。
(3)操作③使加料与馏出液速率大致相等的理由是________。
(4)用饱和Na2CO3溶液洗涤酯的目的是________,用饱和CaCl2溶液洗涤酯的目的是________。
(5)如果同时用Na2CO3与CaCl2两种饱和溶液冼涤酯时,会出现的情况是________。
(6)在粗酯中还杂有的主要有机物是________,产生它的原因是________。
(7)实验时B瓶支管有长导管通向室外的理由是________。
查看习题详情和答案>>
实验室制取乙酸乙酯的装置如图。实验使用的药品如下(烧杯夹持装置、温度计已略去):

a.冰醋酸14.3mL(约0.25mol),b.95%乙醇23mL(约0.37mol),c.浓H2SO4,d.饱和 Na2CO3溶液,e.饱和CaCl2溶液(CaCl2易跟乙醇生成CaCl2·6C2H5OH)。
实验过程主要是将各装置连接好并检查气密性后,进行以下各步骤:
①在蒸馏烧瓶里注入少量乙醇和所需全部浓 H2SO4并混合均匀。在分液漏斗里加入剩下的乙醇和全部冰醋酸并混合均匀。
②用油浴加热,温度保持在130℃~140℃。
③将分液漏斗内液体缓缓滴入蒸馏烧瓶。调节滴入液体速率,使之与馏出酯的滴液速率大致相同,直到加料完毕。
④温度保持一段时间,至没有液体馏出时,停止加热。
⑤取下锥形瓶B,将饱和Na2CO3溶液分批分次加到馏出液里,边加边摇荡至没有气泡产生时为止。
⑥将B中液体在另一分液漏斗中分液,弃去水层。
⑦在分液漏斗油层中加入饱和CaCl2溶液,摇荡后静置,分层分液,弃去水层。油层为粗制乙酸乙酯。
试回答:
(1)配料中的乙醇和乙酸未按物质的量比1∶1配制的理由是________。
(2)浓H2SO4的作用是________。
(3)操作③使加料与馏出液速率大致相等的理由是________。
(4)用饱和Na2CO3溶液洗涤酯的目的是________,用饱和CaCl2溶液洗涤酯的目的是________。
(5)如果同时用Na2CO3与CaCl2两种饱和溶液冼涤酯时,会出现的情况是________。
(6)在粗酯中还杂有的主要有机物是________,产生它的原因是________。
(7)实验时B瓶支管有长导管通向室外的理由是________。
查看习题详情和答案>>
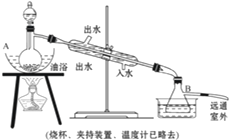 乙酸乙酯是无色具有水果香味的液体,沸点77.2℃,某同学制取它用冰醋酸14.3mL,95%的乙醇 23mL,还用到浓硫酸、饱和碳酸钠以及极易与乙醇结合成六水合物的氯化钙溶液.主要仪器如图所示.
乙酸乙酯是无色具有水果香味的液体,沸点77.2℃,某同学制取它用冰醋酸14.3mL,95%的乙醇 23mL,还用到浓硫酸、饱和碳酸钠以及极易与乙醇结合成六水合物的氯化钙溶液.主要仪器如图所示.实验步骤是:
①先向A中蒸馏烧瓶注入少量乙醇和浓硫酸后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗里待用.这时分液漏斗里两种有机物的物质的量之比约为5:7.
②加热油浴保温约135℃~145℃.
③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加料速度使蒸出酯的速度与进料速度大体相等,直到加料完全.
④保持油浴温度一段时间,至不再有液体流出后,停止加热.
⑤取下B中的锥形瓶,将一定量饱和Na2CO3溶液分批、少量、多次地加到馏出液里,边加边摇荡,至无气泡产生为止.
⑥将⑤的液体混合物分液,弃去水层.
⑦将饱和CaCl2溶液(适量)加入到分液漏斗中,摇荡一段时间后静置,放出水层(废液).
⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品.
试回答:
(1)实验中浓硫酸的主要作用是
(2)用过量乙醇的主要目的是
(3)用饱和Na2CO3溶液洗涤粗酯的目的是
(4)用饱和CaCl2溶液洗涤粗酯的目的是
(5)为什么操作③要使加料与馏出的速度大致相等?
(6)在⑧所示的粗酯里还含有的杂质是