网址:http://m.1010jiajiao.com/timu_id_400129[举报]
 CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.(1)下列措施中,有利于降低大气中的CO2、SO2、NOx浓度的是
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟利昂排放
c.多步行或乘公交车,少用私家车
d.将工业废气用碱液吸收后再排放
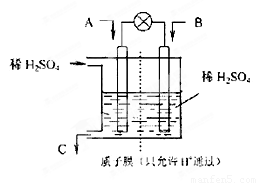
(2)有学者设想以如图所示装置用电化学原理将CO2、SO2转化为重要化工原料.
①若A为CO2,B为H2,C为CH3OH,则正极的电极反应式为
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为
当电路中有1mole-流过,正极区溶液中的H+的物质的量的变化量△n(H+)=
(3)在研究氮的氧化物的转化时,某小组查阅到以下数据:17℃、1.01×l05Pa时,2NO2(g)?N2O4(g)△H<0的平衡常数K=13.3.
①若该条件下密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol?L-1,则c(N2O4)=
②若改变上述体系的某一个条件,达到新的平衡后,测得混合气体中c(NO2)=0.04mol?L-1,c(N2O4)=0.007mol?L-1,则改变的条件为
(4)为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代作为公交车的燃料.
①由CO和H2合成甲醇的方法是CO(g)+2H2(g)?CH3OH(g),己知该反应在300°C时的化学平衡常数为0.27,该温度下将2mol CO、3mol H2利2molCH3OH(g)充入容积为2L的密闭容器中,此时反应将
②己知:
a.用合成气(CO和H2)生产甲醇(CH3OH),合成1mol CH3OH(l)吸收热量131.9kJ
b.2H2(g)+CO(g)+
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
(14分) CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径。
(1)下列措施中,有利于降低大气中的CO2、SO2、NOx浓度的是 (填序号)
A、减少化石燃料的使用,开发新能源
B、使用无氟冰箱,减少氟利昂排放
C、多步行或乘公交车,少用私家车
D、将工业废气用碱液吸收后再排放
(2)有学者设想以右图所示装置用电化学原理将CO2、SO2转化为重要化工原料。
①若A为CO2,B为H2,C为CH3OH,则正极的电极反应式为 ;
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为 ;
当电路中有1 mol e-流过,正极区溶液中的H+的物质的量的变化量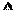 n(H+)=
mol。
n(H+)=
mol。
(3)在研究氮的氧化物的转化时,某小组查阅到以下数据:l7℃、l.01×l05Pa时,2NO2(g) N2O4(g)
△H<0的平衡常数K=13.3。
N2O4(g)
△H<0的平衡常数K=13.3。
①若该条件下密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol.L-1,
则c(N2O4)= 。(保留两位有效数字)
②若改变上述体系的某一个条件,达到新的平衡后,测得混合气体中c(NO2)=0.04 mol.L-1,c(N2O4)=0.007 mol.L-1,则改变的条件为 。
(4)为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代作为公交车的燃料。由CO和H2合成甲醇的方法是CO(g)+2H2(g) CH3OH(g),己知该反应在300OC时的化学平衡常数为0.27,该温度下将2moI CO、3mol H2利2molCH3OH(g)充入容积为2 L的密闭容器中,此时反应将
。(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
CH3OH(g),己知该反应在300OC时的化学平衡常数为0.27,该温度下将2moI CO、3mol H2利2molCH3OH(g)充入容积为2 L的密闭容器中,此时反应将
。(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
查看习题详情和答案>>
(14分) CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径。
(1)下列措施中,有利于降低大气中的CO2、SO2、NOx浓度的是 (填序号)
| A.减少化石燃料的使用,开发新能源 |
| B.使用无氟冰箱,减少氟利昂排放 |
| C.多步行或乘公交车,少用私家车 |
| D.将工业废气用碱液吸收后再排放 |
①若A为CO2,B为H2,C为CH3OH,则正极的电极反应式为 ;
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为 ;
当电路中有1 mol e-流过,正极区溶液中的H+的物质的量的变化量
 n(H+)= mol。
n(H+)= mol。(3)在研究氮的氧化物的转化时,某小组查阅到以下数据:l7℃、l.01×l05Pa时,2NO2(g)
 N2O4(g) △H<0的平衡常数K=13.3。
N2O4(g) △H<0的平衡常数K=13.3。①若该条件下密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol.L-1,
则c(N2O4)= 。(保留两位有效数字)
②若改变上述体系的某一个条件,达到新的平衡后,测得混合气体中c(NO2)="0.04" mol.L-1,c(N2O4)="0.007" mol.L-1,则改变的条件为 。
(4)为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代作为公交车的燃料。由CO和H2合成甲醇的方法是CO(g)+2H2(g)
 CH3OH(g),己知该反应在300OC时的化学平衡常数为0.27,该温度下将2moI CO、3mol H2利2molCH3OH(g)充入容积为2 L的密闭容器中,此时反应将 。(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
查看习题详情和答案>>
CH3OH(g),己知该反应在300OC时的化学平衡常数为0.27,该温度下将2moI CO、3mol H2利2molCH3OH(g)充入容积为2 L的密闭容器中,此时反应将 。(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
查看习题详情和答案>>
(1)下列措施中,有利于降低大气中的CO2、SO2、NOx浓度的是______ (填序号)
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟利昂排放
c.多步行或乘公交车,少用私家车
d.将工业废气用碱液吸收后再排放
(2)有学者设想以如图所示装置用电化学原理将CO2、SO2转化为重要化工原料.
①若A为CO2,B为H2,C为CH3OH,则正极的电极反应式为______;
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为______;
当电路中有1mole-流过,正极区溶液中的H+的物质的量的变化量△n(H+)=______mol.
(3)在研究氮的氧化物的转化时,某小组查阅到以下数据:17℃、1.01×l05Pa时,2NO2(g)?N2O4(g)△H<0的平衡常数K=13.3.
①若该条件下密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol?L-1,则c(N2O4)=______(保留两位有效数字)
②若改变上述体系的某一个条件,达到新的平衡后,测得混合气体中c(NO2)=0.04mol?L-1,c(N2O4)=0.007mol?L-1,则改变的条件为______.
(4)为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代作为公交车的燃料.
①由CO和H2合成甲醇的方法是CO(g)+2H2(g)?CH3OH(g),己知该反应在300°C时的化学平衡常数为0.27,该温度下将2mol CO、3mol H2利2molCH3OH(g)充入容积为2L的密闭容器中,此时反应将______(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”).
②己知:
a.用合成气(CO和H2)生产甲醇(CH3OH),合成1mol CH3OH(l)吸收热量131.9kJ
b.2H2(g)+CO(g)+
 O2(g)═CO2(g)+2H2O(l)△H=-594.1kJ mol-1则表示液态甲醇燃烧热的热化学方程式为______.
O2(g)═CO2(g)+2H2O(l)△H=-594.1kJ mol-1则表示液态甲醇燃烧热的热化学方程式为______.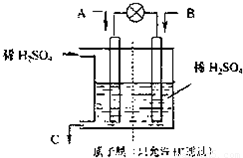 查看习题详情和答案>>
查看习题详情和答案>>
 CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.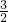 O2(g)═CO2(g)+2H2O(l)△H=-594.1kJ mol-1则表示液态甲醇燃烧热的热化学方程式为______.
O2(g)═CO2(g)+2H2O(l)△H=-594.1kJ mol-1则表示液态甲醇燃烧热的热化学方程式为______.