网址:http://m.1010jiajiao.com/timu_id_399723[举报]
【提出问题】通过实验证明煤中含有碳元素和硫元素.
【查阅资料】
(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色)请完成该反应的化学方程式
根据上述资料,甲、乙、丙三位同学分别设计实验方案进行探究.
【实验探究】
甲同学:
“实验操作”:甲同学进行了如图1所示A、B两步实验:
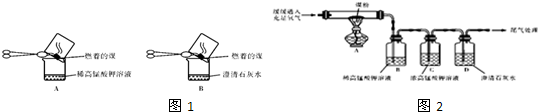
【实验现象】:A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊.
【得出结论】:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素.
(2)乙同学认为甲同学的实验方案不合理,其理由是:
丙同学:
【实验操作】:丙同学进行了如图2所示实验(部分装置在图中略去):
【探究与结论】
(3)上图C装置的作用是
(4)要证明煤中含有碳元素和硫元素的现象
近几年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的,此外,各种机动车排放的尾气也是形成酸雨的重要原因。
【提出问题】通过实验证明煤中含有碳元素和硫元素。
【查阅资料】
(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色)请完成该反应的化学方程式
SO2 + KMnO4 + H2O= K2SO4 + MnSO4 + H2SO4
根据上述资料,甲、乙、丙三位同学分别设计实验方案进行探究。
【实验探究】
甲同学:
“实验操作”:甲同学进行了如下图所示A、B两步实验:

“实验现象”: A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(2)乙同学认为甲同学的实验方案不合理,其理由是: 。
丙同学:
“实验操作”:丙同学进行了如下图所示实验(部分装置在图中略去):

【探究与结论】
(3)上图C装置的作用是 。
(4)要证明煤中含有碳元素和硫元素的现象 。
查看习题详情和答案>>【提出猜想】同学们对溶液中Fe3+和![]() 之间的反应进行了猜想,提出了如下观点:
之间的反应进行了猜想,提出了如下观点:
Ⅰ、认为发生相互促进的水解反应,其离子反应方程式为:
2Fe3++3![]() +6H2O
+6H2O![]() 2Fe(OH)3(胶体)+3H2SO3
2Fe(OH)3(胶体)+3H2SO3
Ⅱ、认为发生氧化还原反应,其离子反应方程式为:
2Fe3++![]() +H2O
+H2O![]() 2Fe2++2H++
2Fe2++2H++![]()
【实验验证】为验证“猜想”,同学们实验如下:
(1)取一定量的Na2SO3固体配成Na2SO3浓溶液。
(2)取5 mL FeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,溶液颜色先由黄色变为红棕色,但无气泡产生,无沉淀生成;继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变成红褐色溶液。
(3)换用稀释的FeCl3和Na2SO3溶液重复上述实验,产生的现象完全相同。
(4)为判断红褐色溶液中含有Fe(OH)3从而证明猜想Ⅰ正确。①部分同学认为只要证明该体系为胶体即可,因此通过_____________现象设计实验方案,证明了其为Fe(OH)3胶体;
②部分同学从反证法的角度考虑,认为只要证明红褐色溶液中仍然有+3价的铁,可说明Fe3+没有被还原为Fe2+则猜想Ⅱ不正确,设计方案为,观察到,从而说明红褐色溶液中含有+3价的铁。
(5)另有部分同学认为只要证明红褐色溶液中含有![]() 可判断猜想Ⅱ正确,因此设计方案为_____________,观察到有白色沉淀生成_____________。
可判断猜想Ⅱ正确,因此设计方案为_____________,观察到有白色沉淀生成_____________。
【解释结论】综合(4)(5)考虑,Fe3+与![]() 的反应类型为_____________。
的反应类型为_____________。
【实验反思】某学同认为(5)中![]() 来源不一定是被Fe3+氧化得到的,因此不能推断猜想Ⅱ正确。你是否赞成该同学的观点_____________(填“是”或“否”)。如果赞成,你对实验改进的建议_____________(如果不赞成,该问不必作答)。
来源不一定是被Fe3+氧化得到的,因此不能推断猜想Ⅱ正确。你是否赞成该同学的观点_____________(填“是”或“否”)。如果赞成,你对实验改进的建议_____________(如果不赞成,该问不必作答)。
【拓展探究】鉴于Na2CO3在组成上与Na2SO3相似,某同学在FeCl3溶液中加入Na2CO3溶液,马上观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是_____________;同学们交流后认为二者水溶液与氯化铁溶液反应的现象差别很大,除![]() 有较强的还原性而
有较强的还原性而![]() 没有还原性的原因外,还可能有的原因是__________________________。
没有还原性的原因外,还可能有的原因是__________________________。
 小明买了一种“汽泡爽”的冲调饮料.
小明买了一种“汽泡爽”的冲调饮料.【饮料说明】
①主要原料:柠檬酸(C6H8O7)和小苏打(NaHCO3);
②使用说明:将一包“汽泡爽”粉末倒入玻璃杯中,加入200mL冷水,看到有大量气泡快速生成,待粉末完全溶解,就得到一杯果味饮料.
小明观察了饮料说明后,他借助化学实验的方法,探究“汽泡爽”产生气体的成分,以及加水温度对产生气体量的影响.
【实验一】探究“汽泡爽”产生气体的成分.
(1)小明阅读资料发现:“汽泡爽”原料中的柠檬酸(C6H8O7)和小苏打(NaHCO3)粉末混合后加水,可以发生以下反应,填写生成气体的化学式.
3NaHCO3+C6H8O7═C6H5O7Na3+3H2O+3
(2)为了检验该气体,小明选择的试剂是
【实验二】探究加水温度对产生气体量的影响.
(1)小明先用冷水和热水各冲了一杯饮料,品尝时发现冷水冲的饮料中气泡较多,热水冲的饮料中气泡较少.当他摇动杯子时,发现有大量气泡从水中逸出.他查阅资料发现:随着温度升高,气体在一定量的水中溶解的量会迅速降低.于是小明设计了如下实验方案,请填写表中空白.
| 实验序号 | 加入水的体积 | 加入水的温度 | 收集到的气体的体积 |
| 1 | 200mL | 15℃ | a(待记录) |
| 2 | 200 mL 200 mL |
50℃ | b(待记录) |
(3)通过实验,小明测得:a=64mL,b=132mL,由此获得结论:“汽泡爽”产生气体的量与加水温度有关系.但是老师看到小明的实验报告后却指出:两套装置中,“汽泡爽”产生气体的总量应该近似相等,与温度关系不大,其本质原因是
(4)通过反思,为了证明老师的观点,小明继续利用(3)中已反应完的两套装置,又做了一步实验,发现两套装置最终收集到的气体的总量确实相近,他的实验操作是
【提出猜想】
①溴水与乙醛发生取代反应.
②
③
【设计方案】
方案一:检验褪色后溶液的酸碱性.
方案二:测定反应前溴水中Br2的物质的量和反应后Br-离子的物质的量.
【实验探究】
取含0.005mol Br2的溶液10mL,加入足量乙醛溶液使其褪色,再加入过量AgNO3溶液,过滤、洗涤、干燥后称重固体质量为1.88g.
【解释与结论】
假设测得反应前溴水中Br2的物质的量为a mol,若测得反应后n(Br-)=0mol,则说明溴水与乙醛发生了
[反思与评价]
方案一是否可行?