网址:http://m.1010jiajiao.com/timu_id_399711[举报]
A.蒸馏;B.盐析;C.过滤;D.重结晶;E、升华;F、渗析;G、电解;H、加热分解;I.洗气.如欲分离或提纯下列各组混合物,请选择上述方法中最合适者,并将相应字母填入题后空格内:
(1)除去淀粉溶液中的少量碘化钠
(2)从油脂皂化反应后的混合液中分离出高级脂肪酸钠
(3)除去粗铜中锌、银等金属
(4)除去水中的Na+、SO42-、Cl-等杂质
(5)除去KNO3晶体中混有的少量NaCl
II.某学生完成硫酸铜晶体结晶水含量测定实验得到以下数据:
| 加热前质量 | 加热前质量 | 加热后质量 |
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) |
| 160(W2-W3) |
| 18(W3-W1) |
| 160(W2-W3) |
| 18(W3-W1) |
III.50mL0.50mol?L-1盐酸和50mL 0.55mol?L-1烧碱溶液进行中和反应,若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为①2.3℃②2.4℃③2.9℃,则△H=
| 0.418×2.35 |
| 0.025 |
| 0.418×2.35 |
| 0.025 |
(14分)镁、铝是两种重要的金属,它们的单质及化合物有着各自的性质。
Ⅰ.海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,某同学设计了如下
流程步骤:
主要的步骤总结如下:①把贝壳制成石灰乳 ②往母液中加石灰乳,沉降、过滤,得到Mg(OH)2沉淀 ③将沉淀物与盐酸反应,结晶、过滤,将制得的晶体脱水得无水MgCl2
④将得到的产物熔融后电解。
(1)下列说法不正确的是__________________(填代号)
| A.此法的优点之一是原料来源丰富 |
| B.进行①②③步骤的目的是从海水中提取氯化镁 |
| C.第④步电解法制取镁是由于镁是很活泼的金属 |
| D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |
Ⅱ.(1)铝、空气、海水可组成一种电池,广泛用于制造航标灯。此电池正极的电极反应为 。
(2)铝热还原法是冶炼熔点较高的金属的一种重要方法,焊接钢轨即用到此法。将干燥的氧化铁粉末和铝粉均匀混合后放入纸漏斗中(漏斗已事先处理好),并架在铁架台上,
下面放置一个盛有沙子的蒸发皿。请写出引发铝热反应的操作及该反应的化学方程式:
操作
化学方程式 。
(3)为确定某铝热剂(氧化铁粉末和铝粉)的组成,分别进行下列实验。
若取10.7g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况)体积为3.36L,反应的化学方程式为 ,样品中铝的质量是 g。
若取10.7g样品将其点燃,恰好完全反应,待反应产物冷却后,加入足量盐酸,测得生成的气体体积为aL,该气体与上小题中所得气体的体积比等于 ∶ 。 查看习题详情和答案>>
(14分)镁、铝是两种重要的金属,它们的单质及化合物有着各自的性质。
Ⅰ.海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,某同学设计了如下
流程步骤:

主要的步骤总结如下:①把贝壳制成石灰乳 ②往母液中加石灰乳,沉降、过滤,得到Mg(OH)2沉淀 ③将沉淀物与盐酸反应,结晶、过滤,将制得的晶体脱水得无水MgCl2
④将得到的产物熔融后电解。
(1)下列说法不正确的是__________________(填代号)
A.此法的优点之一是原料来源丰富
B.进行①②③步骤的目的是从海水中提取氯化镁
C.第④步电解法制取镁是由于镁是很活泼的金属
D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应
(2)步骤②不够合理,理由是
Ⅱ.(1)铝、空气、海水可组成一种电池,广泛用于制造航标灯。此电池正极的电极反应为 。
(2)铝热还原法是冶炼熔点较高的金属的一种重要方法,焊接钢轨即用到此法。将干燥的氧化铁粉末和铝粉均匀混合后放入纸漏斗中(漏斗已事先处理好),并架在铁架台上,
下面放置一个盛有沙子的蒸发皿。请写出引发铝热反应的操作及该反应的化学方程式:
操作
化学方程式 。
(3)为确定某铝热剂(氧化铁粉末和铝粉)的组成,分别进行下列实验。
若取10.7 g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况)体积为3.36 L ,反应的化学方程式为 ,样品中铝的质量是 g。
若取10.7 g样品将其点燃,恰好完全反应,待反应产物冷却后,加入足量盐酸,测得生成的气体体积为a L,该气体与上小题中所得气体的体积比等于 ∶ 。
查看习题详情和答案>>
Ⅰ.海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,某同学设计了如下
流程步骤:
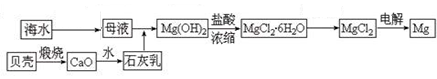
主要的步骤总结如下:①把贝壳制成石灰乳 ②往母液中加石灰乳,沉降、过滤,得到Mg(OH)2沉淀 ③将沉淀物与盐酸反应,结晶、过滤,将制得的晶体脱水得无水MgCl2
④将得到的产物熔融后电解。
(1)下列说法不正确的是__________________(填代号)
| A.此法的优点之一是原料来源丰富 |
| B.进行①②③步骤的目的是从海水中提取氯化镁 |
| C.第④步电解法制取镁是由于镁是很活泼的金属 |
| D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |
Ⅱ.(1)铝、空气、海水可组成一种电池,广泛用于制造航标灯。此电池正极的电极反应为 。
(2)铝热还原法是冶炼熔点较高的金属的一种重要方法,焊接钢轨即用到此法。将干燥的氧化铁粉末和铝粉均匀混合后放入纸漏斗中(漏斗已事先处理好),并架在铁架台上,
下面放置一个盛有沙子的蒸发皿。请写出引发铝热反应的操作及该反应的化学方程式:
操作
化学方程式 。
(3)为确定某铝热剂(氧化铁粉末和铝粉)的组成,分别进行下列实验。
若取10.7g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况)体积为3.36L,反应的化学方程式为 ,样品中铝的质量是 g。
若取10.7g样品将其点燃,恰好完全反应,待反应产物冷却后,加入足量盐酸,测得生成的气体体积为aL,该气体与上小题中所得气体的体积比等于 ∶ 。
(17分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验,在体积为2L的密闭容器中,充入1molCO2和3.25molH2,在一定条件下发生反应,测定CO2、CH3OH和H2O(g)的浓度随时间变化如图所示:
①写出该工业方法制取甲醇的化学方程式: 。
②从反应开始到平衡,氢气的平均反应速率v(H2)= 。
③反应到达平衡后,再向该容器中通入1 mol CO2和3.25 mol H2,重新到达平衡后,H2的转化率将 (填增大、减小或不变)
④下列措施中一定能使n(CH3OH)/ n(CO2)增大的是: 。
A.向容器中充入一定量的氦气 B.充入CO2
C.将水蒸气从体系中分离 D.用更有效的催化剂
(2)可燃性的有机物和氧气在理论上都可以作为燃料电池中的反应物,请写出CH3OH —O2—KOH燃料电池的负极的电极反应式:
(3)若将一定数量的C3H8—O2—KOH燃料电池按一定方式组成电池组以满足电解需要的电压。现用该电池组电解500mL某CuSO4的稀溶液(用铂为电极),电解后的溶液需要加入98克Cu(OH)2才能使溶液恢复到原硫酸铜溶液的浓度和质量。若忽略电池组在电解过程中的能量损失,其能量全部用来电解CuSO4溶液,则:
①原CuSO4溶液物质的量浓度
②该电池组消耗的丙烷在标准状况时的体积
查看习题详情和答案>>