摘要:课外作业
网址:http://m.1010jiajiao.com/timu_id_399561[举报]
某课外小组设计如图1所示装置进行探究实验(夹持装置已略去).
(1)实验过程中,使用分液漏斗滴加液体的操作是
(2)利用该装置抽取氨气并测量其体积,请回答下列有关问题.
①反应前,烧瓶中可加入的试剂是
a.稀NaOH溶液;b.CaO;c.煤油;d.氯化铵溶液;e.NaOH固体;f.氨水.
②该实验剩余的NH3需吸收处理.如图2所示的各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有
③本实验就对量气管多次读数,读数时应注意:Ⅰ.将实验装置恢复到室温;Ⅱ.
(3)该小组同学欲利用NH3、CO2和NaC1溶液模拟工业制碱,则在饱和NaC1溶液中通入气体的顺序依次为
(4)某同学认为利用上述所设计的装置也可进行铜与稀硝酸的反应,通过收集并测量NO气体的体积以测定铜的纯度.你认为
查看习题详情和答案>>

(1)实验过程中,使用分液漏斗滴加液体的操作是
打开分液漏斗上口的活塞(或将活塞上的凹槽与瓶口上的小孔对齐),旋开分液漏斗的旋塞,缓慢滴加
打开分液漏斗上口的活塞(或将活塞上的凹槽与瓶口上的小孔对齐),旋开分液漏斗的旋塞,缓慢滴加
.(2)利用该装置抽取氨气并测量其体积,请回答下列有关问题.
①反应前,烧瓶中可加入的试剂是
be
be
,量气装置中的液体最好换用c
c
(填字母编号).a.稀NaOH溶液;b.CaO;c.煤油;d.氯化铵溶液;e.NaOH固体;f.氨水.
②该实验剩余的NH3需吸收处理.如图2所示的各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有
BCE
BCE
(填字母编号).③本实验就对量气管多次读数,读数时应注意:Ⅰ.将实验装置恢复到室温;Ⅱ.
使量气管内液面与干燥管内液面相平
使量气管内液面与干燥管内液面相平
;Ⅲ.视线与凹液面最低处相平.(3)该小组同学欲利用NH3、CO2和NaC1溶液模拟工业制碱,则在饱和NaC1溶液中通入气体的顺序依次为
NH3、CO2
NH3、CO2
,其反应的化学方程式为NH3+CO2+NaC1+H2O=NH4C1+NaHCO3↓
NH3+CO2+NaC1+H2O=NH4C1+NaHCO3↓
.(4)某同学认为利用上述所设计的装置也可进行铜与稀硝酸的反应,通过收集并测量NO气体的体积以测定铜的纯度.你认为
不可行
不可行
(填“可行”或“不可行”),理由是NO会与装置中空气反应,生成NO2溶于水,使测得的NO气体体积不准
NO会与装置中空气反应,生成NO2溶于水,使测得的NO气体体积不准
.某课外小组研究铝土矿中Al2O3的含量.查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等.从铝土矿中提取Al2O3的过程如下:
(1)固体B的主要用途有(写出1条即可):
(2)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是:
第③步中,生成氢氧化铝的化学方程式是:
(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是:
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5mol 碳单质,转移1mol电子,反应的化学方程式是
查看习题详情和答案>>

(1)固体B的主要用途有(写出1条即可):
炼铁原料、用作涂料、油漆等
炼铁原料、用作涂料、油漆等
.(2)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是:
Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
;SiO2+2OH-=SiO32-+H2O
SiO2+2OH-=SiO32-+H2O
;第③步中,生成氢氧化铝的化学方程式是:
AlCl3+3NH3?H2O=Al(OH)3↓+3NH4Cl
AlCl3+3NH3?H2O=Al(OH)3↓+3NH4Cl
.(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是:
65.4%
65.4%
.(保留一位小数)(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5mol 碳单质,转移1mol电子,反应的化学方程式是
Al2O3+3Cl2+3C
2AlCl3+3CO
| ||
Al2O3+3Cl2+3C
2AlCl3+3CO
.
| ||
某课外小组利用图1装置在实验室制取SO2并探究其有关性质.
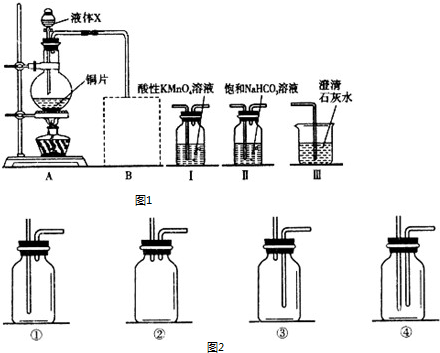
请回答下列问题:
(1)液体X是 .
(2)写出烧瓶中发生反应的化学方程式: .
(3)在图1中虚线框的位置连接有一个安全装置(气体流向从左至右),可以选用图2装置中的 (填写序号).
(4)SO2溶于水后生成亚硫酸,为了验证酸性:H2SO3>H2CO3,则图2中装置Ⅰ、Ⅱ、Ⅲ的正确连接顺序是 接 接 (用Ⅰ、Ⅱ、Ⅲ填空).
(5)按(4)中连接顺序进行实验,证明酸性H2SO3>H2CO3的现象是 ,KMnO4溶液的作用是 .
(6)我国工业上SO2是利用黄铁矿在 (填设备名称)中高温煅烧制得的.请计算煅烧1t含FeS2的质量分数为60%的黄铁矿矿石在理论上能生产多少吨浓度为98%的硫酸?(设生产过程中共损失硫2%)(要求写必要的计算过程) .
查看习题详情和答案>>

请回答下列问题:
(1)液体X是
(2)写出烧瓶中发生反应的化学方程式:
(3)在图1中虚线框的位置连接有一个安全装置(气体流向从左至右),可以选用图2装置中的
(4)SO2溶于水后生成亚硫酸,为了验证酸性:H2SO3>H2CO3,则图2中装置Ⅰ、Ⅱ、Ⅲ的正确连接顺序是
(5)按(4)中连接顺序进行实验,证明酸性H2SO3>H2CO3的现象是
(6)我国工业上SO2是利用黄铁矿在
某课外小组对一些金属单质和化合物的性质进行研究.
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应 ;
化合反应 .
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡.持续电解,在阴极附近的溶液中还可以观察到的现象是 .
解释此现象的离子方程式是 .
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来.
①用铝与软锰矿冶炼锰的原理是(用化学方程式来表示) .
②MnO2在H2O2分解反应中作催化剂.若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是 .
查看习题详情和答案>>
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中. | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色. |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中. | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
置换反应
化合反应
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡.持续电解,在阴极附近的溶液中还可以观察到的现象是
解释此现象的离子方程式是
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来.
①用铝与软锰矿冶炼锰的原理是(用化学方程式来表示)
②MnO2在H2O2分解反应中作催化剂.若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是
 某课外小组利用如图装置进行相关实验,请回答下列问题.
某课外小组利用如图装置进行相关实验,请回答下列问题.