网址:http://m.1010jiajiao.com/timu_id_399446[举报]
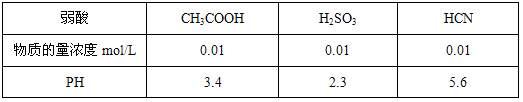
25°C时,几种弱酸溶液的PH如下表所示:
|
弱酸 |
CH3COOH |
H2SO3 |
HCN |
|
物质的量浓度mol/L |
0.01 |
0.01 |
0.01 |
|
PH |
3.4 |
2.3 |
5.6 |
下列有关说法正确的是
A.相同PH的CH3COOH与HCN溶液中水电离的氢离子浓度CH3COOH溶液中的大
B.物质的量浓度相同的CH3COONa与NaCN溶液中,各离子浓度之和两者相等。
C.25°C时,HCN溶液的电离平衡常数(Ka)与NaCN溶液的水解平衡常数(K)存在
如下关系:Ka ·K = Kw
D.0.01mol/L的Na2SO3溶液与0.01mol/L的CH3COONa溶液相比,一定是后者的碱性强
查看习题详情和答案>>
| 弱酸 | CH3COOH | H2SO3 | HCN |
| 物质的量浓度mol/L | 0.01 | 0.01 | 0.01 |
| PH | 3.4 | 2.3 | 5.6 |
A.相同PH的CH3COOH与HCN溶液中水电离的氢离子浓度CH3COOH溶液中的大
B.物质的量浓度相同的CH3COONa与NaCN溶液中,各离子浓度之和两者相等。
C.25°C时,HCN溶液的电离平衡常数(Ka)与NaCN溶液的水解平衡常数(K)存在
如下关系:Ka ·K = Kw
D.0.01mol/L的Na2SO3溶液与0.01mol/L的CH3COONa溶液相比,一定是后者的碱性强
B.物质的量浓度相同的CH3COONa与NaCN溶液中,各离子浓度之和两者相等
C.25°C时,HCN溶液的电离平衡常数(Ka)与NaCN溶液的水解平衡常数(K)存在如下关系:Ka·K = Kw
D.0.01mol/L的Na2SO3溶液与0.01mol/L的CH3COONa溶液相比,一定是后者的碱性强
25°C时,几种弱酸溶液的PH如下表所示:
| 弱酸 | CH3COOH | H2SO3 | HCN |
| 物质的量浓度mol/L | 0.01 | 0.01 | 0.01 |
| PH | 3.4 | 2.3 | 5.6 |
A.相同PH的CH3COOH与HCN溶液中水电离的氢离子浓度CH3COOH溶液中的大
B.物质的量浓度相同的CH3COONa与NaCN溶液中,各离子浓度之和两者相等。
C.25°C时,HCN溶液的电离平衡常数(Ka)与NaCN溶液的水解平衡常数(K)存在
如下关系:Ka ·K = Kw
D.0.01mol/L的Na2SO3溶液与0.01mol/L的CH3COONa溶液相比,一定是后者的碱性强 查看习题详情和答案>>
水溶液中存在多种平衡,请回答下列问题。
(1)有下列几种溶液:a. NH3·H2O b. CH3COONa c. NH4Cl d. NaHSO4
常温下呈酸性的溶液有 (填序号)。
(2)已知NaHCO3溶液呈碱性,该溶液中除水的电离外还存在着两个平衡,用电离方程式或离子方程式表示: 、
,该溶液中的离子浓度由大到小的顺序是: 。
(3)有浓度均为0.1 mol?L-1的 ①盐酸②硫酸③醋酸三种溶液,请用序号填空:
三种溶液的c(H+)大小顺序为 ;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次的大小关系为 ;若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,此时三种溶液的pH的大小关系为 。
(4)25℃时,AgCl的Ksp=1.8×10-10 ,试写出AgCl溶解平衡的表达式: ,现将足量AgCl固体投入100mL0.1mol/L MgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)= mol/L(忽略溶液体积的变化)。