网址:http://m.1010jiajiao.com/timu_id_399410[举报]
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看做是化学平衡的一种。请根据所学化学知识回答下列问题:
Ⅰ、(12分)已知0.01mol/L的NaHCO3溶液呈碱性。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① ② 。
(2)溶液中共有 种不同的粒子(指分子和离子)。
(3)该溶液中的离子浓度由大到小的顺序是: 。
(4)向该溶液中加入AlCl3溶液,有白色胶状沉淀生成,同时产生一种无色无味并能使澄清石灰水变浑浊的气体,写出该反应的离子方程式: 。
Ⅱ、(6分)有盐酸、硫酸、醋酸三种溶液,试回答:
(1)若三种溶液的浓度均为0.1 mol•L-1,其c(H+)依次为a mol•L-1,b mol•L-1,c mol•L-1,其大小顺序为 ;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为 。
(2)若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,此时三种溶液的pH1、pH2、pH3之间的关系为 (用“<”、“>”或“=”表示,pH1 ——代表盐酸、 pH2 ——代表硫酸、pH3——代表醋酸)
Ⅲ、(4分)已知含有足量AgCl固体的饱和溶液中存在如下平衡:AgCl(s)Ag+(aq)+Cl-(aq),且在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl固体分别放入下列液体中:①100mL蒸馏水
②100mL0.3mol/L AgNO3溶液 ③100mL0.1mol/LMgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)由大到小的顺序为 (填序号),溶液②中c(Cl-)= 。
查看习题详情和答案>>
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看做是化学平衡的一种。请根据所学化学知识回答下列问题:
Ⅰ、(12分)已知0.01mol/L的NaHCO3溶液呈碱性。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① ② 。
(2)溶液中共有 种不同的粒子(指分子和离子)。
(3)该溶液中的离子浓度由大到小的顺序是: 。
(4)向该溶液中加入AlCl3溶液,有白色胶状 沉淀生成,同时产生一种无色无味并能使澄清石灰水变浑浊的气体,写出该反应的离子方程式: 。
沉淀生成,同时产生一种无色无味并能使澄清石灰水变浑浊的气体,写出该反应的离子方程式: 。
Ⅱ、(6分)有盐酸、硫酸、醋酸三种溶液,试回答:
(1)若三种溶液的浓度均为0.1 mol?L-1,其c(H+) 依次为a mol?L-1,b mol?L-1,c mol?L-1,其大小顺序为 ;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为 。
(2)若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,此时三种溶液的pH1、pH2、pH3之间的关系为 (用“<”、“>”或“=”表示,pH1 ——代表盐酸、 pH2 ——代表硫酸、pH3 ——代表醋酸)
Ⅲ、(4分)已知含有足量AgCl固体的饱和溶液中存在如下平衡:AgCl(s) Ag+(aq)+Cl-(aq),且在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl固体分别放入下列液体中:①100mL蒸馏水
Ag+(aq)+Cl-(aq),且在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl固体分别放入下列液体中:①100mL蒸馏水
②100mL0.3mol/L AgNO3溶液 ③100mL0.1mol/L MgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)由大到小的顺序为 (填序号),溶液②中c(Cl-)= 。
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看做是化学平衡的一种。请根据所学化学知识回答下列问题:
Ⅰ、(12分)已知0.01mol/L的NaHCO3溶液呈碱性。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① ② 。
(2)溶液中共有 种不同的粒子(指分子和离子)。
(3)该溶液中的离子浓度由大到小的顺序是: 。
(4)向该溶液中加入AlCl3溶液,有白色胶状沉淀生成,同时产生一种无色无味并能使澄清石灰水变浑浊的气体,写出该反应的离子方程式: 。
Ⅱ、(6分)有盐酸、硫酸、醋酸三种溶液,试回答:
(1)若三种溶液的浓度均为0.1 mol•L-1,其c(H+) 依次为a mol•L-1,b mol•L-1,c mol•L-1,其大小顺序为 ;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为 。
(2)若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,此时三种溶液的pH1、pH2、pH3之间的关系为 (用“<”、“>”或“=”表示,pH1 ——代表盐酸、 pH2 ——代表硫酸、pH3 ——代表醋酸)
Ⅲ、(4分)已知含有足量AgCl固体的饱和溶液中存在如下平衡:AgCl(s) Ag+(aq)+Cl-(aq),且在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl固体分别放入下列液体中:①100mL蒸馏水
Ag+(aq)+Cl-(aq),且在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl固体分别放入下列液体中:①100mL蒸馏水
②100mL0.3mol/L AgNO3溶液 ③100mL0.1mol/L MgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)由大到小的顺序为 (填序号),溶液②中c(Cl-)= 。
查看习题详情和答案>>
Ⅰ、(12分)已知0.01mol/L的NaHCO3溶液呈碱性。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① ② 。
(2)溶液中共有 种不同的粒子(指分子和离子)。
(3)该溶液中的离子浓度由大到小的顺序是: 。
(4)向该溶液中加入AlCl3溶液,有白色胶状
 沉淀生成,同时产生一种无色无味并能使澄清石灰水变浑浊的气体,写出该反应的离子方程式: 。
沉淀生成,同时产生一种无色无味并能使澄清石灰水变浑浊的气体,写出该反应的离子方程式: 。Ⅱ、(6分)有盐酸、硫酸、醋酸三种溶液,试回答:
(1)若三种溶液的浓度均为0.1 mol?L-1,其c(H+) 依次为a mol?L-1,b mol?L-1,c mol?L-1,其大小顺序为 ;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为 。
(2)若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,此时三种溶液的pH1、pH2、pH3之间的关系为 (用“<”、“>”或“=”表示,pH1 ——代表盐酸、 pH2 ——代表硫酸、pH3 ——代表醋酸)
Ⅲ、(4分)已知含有足量AgCl固体的饱和溶液中存在如下平衡:AgCl(s)
 Ag+(aq)+Cl-(aq),且在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl固体分别放入下列液体中:①100mL蒸馏水
Ag+(aq)+Cl-(aq),且在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl固体分别放入下列液体中:①100mL蒸馏水②100mL0.3mol/L AgNO3溶液 ③100mL0.1mol/L MgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)由大到小的顺序为 (填序号),溶液②中c(Cl-)= 。
(15分)已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。
![]()
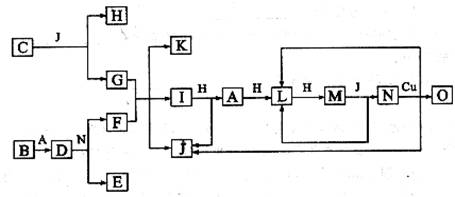
![]() 请回答下列问题:
请回答下列问题:
(1) ![]() 组成B单质的元素位于周期表第______________周期,第_______________族。化合物C的电子式为__________________________________。
组成B单质的元素位于周期表第______________周期,第_______________族。化合物C的电子式为__________________________________。
(2) J的沸点比硒化氢(H2Se)的沸点高,其原因是_________________。
(3) 写出I与H在点燃条件下反应生成A和J的化学方程式:________________。
(4) 写出D与足量的N反应生成E和F的化学方程式:_____________________。
(5) 上图中,在同一反应里一种物质作氧化剂,又作还原剂,这样的反应共有_______个。
查看习题详情和答案>>