网址:http://m.1010jiajiao.com/timu_id_399325[举报]
(1)逆:是指化学平衡研究的对象是_____________________。
(2)动:是指_________平衡,达到平衡状态时,正逆反应仍在不断进行,只是________________ _________________________而已。
(3)等:达到平衡状态时,_________________________相等,但不等于零。即v(正)=v(逆)≠0。
(4)定:平衡时,各组分的_____________保持一定,各组成成分的_____________保持一定。
(5)变:当外界条件(如浓度、压强、温度等)变化时,则原平衡被破坏,反应混合物中各组分的浓度就会发生变化,在新的条件下会重新建立平衡。
查看习题详情和答案>>| 时间(min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 10 | 7 | 5 | 3.5 | 2 | 1 | 1 | 1 |
| O2 | 5 | 3.5 | 2.5 | 1.75 | 1 | 0.5 | 0.5 | 0.5 |
| SO3 | 0 | 3 | 5 | 6.5 | 8 | 9 | 9 | 9 |
(2)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2:7%,O2:11%,N2:82%):
| 压强/MPa 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
②在400一500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:
③工业制硫酸所产生的尾气含有SO2、微量的SO3和酸雾.为了保护环境将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:
④能用于测定硫酸尾气中SO2含量的是
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液
⑤某温度下,SO2氧化为SO3在10L的密闭容器中进行,开始向容器加入4.0mol SO2和10.0molO2,当反应达到平衡时,混合气体为13.0mol,则SO2的转化率为
(1)若从下列四个地区选址新建一座硫酸厂,最合适的地点应在 附近。?
a.风景旅游区 b.硫酸消耗中心区? c.人口稠密区 d.黄铁矿矿区?
(2)工业生产硫酸的原料气成分(体积分数)为:SO27%,O211%,N2 82%。压强及温度对SO2转化率的影响如下:?
工业上,二氧化硫催化氧化过程采用的是常压而不是高压,主要原因是 。?
分析上表数据可知,二氧化硫的催化氧化是放热反应,理由是 。
(3)据测算,接触法制硫酸过程中,每生产1t 98%的硫酸需消耗3.60×105 kJ能量。若反应:2SO2(g)+O2(g)![]() 2SO3(g),ΔH =-196.6 kJ·mol-1放出的热量完全被利用,则每生产1t 98%的硫酸可为外界提供 kJ能量(不考虑其他过程释放的能量)。?
2SO3(g),ΔH =-196.6 kJ·mol-1放出的热量完全被利用,则每生产1t 98%的硫酸可为外界提供 kJ能量(不考虑其他过程释放的能量)。?
(4)依据题给数据计算:在500 ℃ 0.1 MPa条件下,二氧化硫的催化氧化达到平衡时,各种气体的体积比V(SO2)∶V(SO3)∶V(O2)∶V(N2)= ∶ ∶ ∶ (结果保留两位有效数字)。
查看习题详情和答案>>硫的氧化物、氮的氧化物和一氧化碳是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一。
(1)有下列反应:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
S(g)与O2(g)反应生成SO2(g)的热化学方程式为 。
![]() (2)一定条件下,2SO2(g)+O2(g) 2SO3(g),向2L密闭容器中通入
(2)一定条件下,2SO2(g)+O2(g) 2SO3(g),向2L密闭容器中通入
2 mol SO2(g)、1 mol O2(g)和0.2 mol SO3(g),2 min后反应达到平衡时,测得SO2的物质的量为1 mol,恒温下,若往容器中再加入2 mol SO2(g),则重新达到平衡时SO2的总转化率 50%(选填“>","<"或"=")。
![]() (3)在一密闭容器中发生反应2NO2 2NO+O2,反应过程中NO2的浓度随时间变化
(3)在一密闭容器中发生反应2NO2 2NO+O2,反应过程中NO2的浓度随时间变化
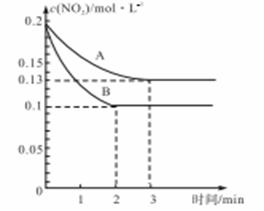 的情报况如下图所示,请回答:
的情报况如下图所示,请回答:
①依曲线A,反应在前3min内氧气的平均反应速率为 ;
②若曲线A、B分别表示的是该反应在保持其他条件不变时,只改变其中一个外界条件时的变化情况,则此条件是
(填“浓度”、“压强”、“温度”或“催化剂”)
![]() (4)工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g)
(4)工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g)
某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.l mol·L -1。
①该反应的平衡常数K= :
②在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有
关说法正确的是 (填序号)。
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2) / n(CH3OH)增大
查看习题详情和答案>>