摘要:⑤CO(g)+NO2(g) CO2.ΔH < 0,计算题
网址:http://m.1010jiajiao.com/timu_id_399070[举报]
 Ⅰ.一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)
Ⅰ.一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0(1)下列措施中能使平衡时
| c(CO) | c(CO2) |
B
B
(填序号).A.增大压强 B.升高温度 C.充入一定量氮气 D.再加入一些铁粉
(2)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,则CO2的转化率将
不变
不变
(填“增大”、“减小”、“不变”).(3)铁的重要化合物在生产生活中应用十分广泛,高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂.
①高铁酸钠生产方法之一是在强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物.现产生了66.4g高铁酸钠,转移电子数目为
1.2NA或1.2×6.02×1023
1.2NA或1.2×6.02×1023
.②高铁酸钠生产方法之二电解法:用隔膜式电解槽,在浓碱溶液中,经过电解,将Fe氧化成高铁酸盐.实验室中可用右图所示装置进行实验.写出阳极的电极反应式
Fe+8OH--6e-=FeO42-+4H2O
Fe+8OH--6e-=FeO42-+4H2O
Ⅱ.硝酸是一种重要的化工原料,而氨气是工业生产硝酸的重要原料.
(1)据报道用Mg与石墨作电极与NH4Cl溶液形成原电池,也可生成NH3.其反应是Mg+2NH4Cl=MgCl2+2NH3↑+H2↑,写出该电池正极的电极反应式
2NH4++2e-=2NH3↑+H2↑
2NH4++2e-=2NH3↑+H2↑
.(2)硝酸厂常用碱液吸收法处理尾气:用Na2CO3溶液吸收NO2生成CO2.若每2mol NO2和Na2CO3溶液反应时转移电子1mol,则反应的离子方程式是
2NO2+CO32-=NO3-+NO2-+CO2
2NO2+CO32-=NO3-+NO2-+CO2
.研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义.
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S.
已知:①CO(g)+
O2(g)=CO2(g)△H=-283.0KJ?mol-1
②S(s)+O2(g)=SO2(g)△H=-296.0KJ?mol-1
此反应的热化学方程式是
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体.已知:
①CO(g)+NO2(g)=NO(g)+CO2(g)△H=-a KJ?mol-1(a>0)
②2CO(g)+2NO (g)=N2(g)+2CO2(g)△H=-b KJ?mol-1(b>0)
若用标准状况下 3.36L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为
(3)用CH4催化还原NOx也可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574KJ?mol-1①
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=?②
若1mol CH4还原NO2至N2整个过程中放出的热量为867KJ,则△H2=
查看习题详情和答案>>
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S.
已知:①CO(g)+
| 1 | 2 |
②S(s)+O2(g)=SO2(g)△H=-296.0KJ?mol-1
此反应的热化学方程式是
2CO(g)+SO2(g)=S(s)+2CO2(g)△H1=-270KJ?mol-1
2CO(g)+SO2(g)=S(s)+2CO2(g)△H1=-270KJ?mol-1
.(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体.已知:
①CO(g)+NO2(g)=NO(g)+CO2(g)△H=-a KJ?mol-1(a>0)
②2CO(g)+2NO (g)=N2(g)+2CO2(g)△H=-b KJ?mol-1(b>0)
若用标准状况下 3.36L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为
0.3
0.3
mol,放出的热量为3(2a+b)/80
3(2a+b)/80
KJ(用含有a和b的代数式表示).(3)用CH4催化还原NOx也可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574KJ?mol-1①
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=?②
若1mol CH4还原NO2至N2整个过程中放出的热量为867KJ,则△H2=
-1160KJ/mol
-1160KJ/mol
.(1)二甲醛(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:
①CO(g)+2H2(g)?CH3OH(g)△H1=-91kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H1=-24kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H1=-41kJ?mol-1
新工艺的总反应为:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)该反应△H=
(2)处理含CO、NO2废气污染的一种方法,是将其在催化剂作用下转化为单质N2.已知:
CO(g)+
O2(g)═CO2(g)△H=-283.0kJ?mol-1
N2(g)+O2(g)═NO2(g)△H=-296.0kJ?mol-1
此反应的热化学方程式是 .
查看习题详情和答案>>
①CO(g)+2H2(g)?CH3OH(g)△H1=-91kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H1=-24kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H1=-41kJ?mol-1
新工艺的总反应为:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)该反应△H=
(2)处理含CO、NO2废气污染的一种方法,是将其在催化剂作用下转化为单质N2.已知:
CO(g)+
| 1 |
| 2 |
| 1 |
| 2 |
此反应的热化学方程式是
氮是地球上含量丰富的一种元素,氮元素的单质和化合物在工农业生产、生活中有重要用途.
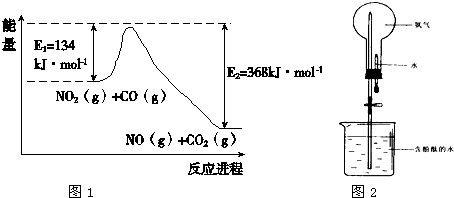
(1)根据图1能量变化示意图:写出CO和NO2反应生成NO和CO2的热化学方程式
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如下表,试判断K1
(3)下列各项能说明该反应达到平衡状态的是
a.v正(H2)=3v逆(N2)
b.容器内压强保持不变
c.容器中混合气体的密度保持不变
d.N2、H2、NH3的浓度之比为1:3:2
(4)氨气极易溶于水,常用如图2实验来验证,在标准状况下,烧瓶中的氨水使酚酞变红.请回答:
①用化学用语说明所得氨水能使酚酞变红的原因
②25℃时,将一定量的氨水与盐酸混合后pH=7,测该混合溶液中c(Cl-)与c(NH4+)关系为
a.c(Cl-)>c(NH4+) b.c(Cl-)﹦c(NH4+)
c.c(Cl-)<c(NH4+) d.无法判断.
查看习题详情和答案>>

(1)根据图1能量变化示意图:写出CO和NO2反应生成NO和CO2的热化学方程式
CO(g)+NO2(g)═CO2(g)+NO(g)△H=-234kJ/mol
CO(g)+NO2(g)═CO2(g)+NO(g)△H=-234kJ/mol
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如下表,试判断K1
>
>
K2(填“>”、“=”或“<”)| T/K | 298 | 398 |
| 平衡常数K | K1 | K2 |
ab
ab
(填字母序号)a.v正(H2)=3v逆(N2)
b.容器内压强保持不变
c.容器中混合气体的密度保持不变
d.N2、H2、NH3的浓度之比为1:3:2
(4)氨气极易溶于水,常用如图2实验来验证,在标准状况下,烧瓶中的氨水使酚酞变红.请回答:
①用化学用语说明所得氨水能使酚酞变红的原因
NH3?H2O?NH4++OH-
NH3?H2O?NH4++OH-
.②25℃时,将一定量的氨水与盐酸混合后pH=7,测该混合溶液中c(Cl-)与c(NH4+)关系为
b
b
(填字母序号)a.c(Cl-)>c(NH4+) b.c(Cl-)﹦c(NH4+)
c.c(Cl-)<c(NH4+) d.无法判断.
(2012?天津模拟)为改善大气质量,国家拟于“十二五”期间,力争将CO2变为燃料或有机化学产品的构想变为现实,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.
I.一种将CO2变为燃料或有机化学产品的构想分成3个步骤:
①利用浓碳酸钾溶液吸收空气中的CO2;
②将第①步吸收液电解产生H2和O2,同时分离出CO2;
③将第②步产生的H2(g)和CO2(g)在一定条件下转化成CH4(g)和H2O(l).
已知:H2(g)+
O2(g)=H2O(l)△H1=-285.8kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2=-889.6kJ/mol
写出第③步反应的热化学方程式为
II.目前,消除大气污染有多种方法.
(1)处理NOx的一种方法是利用甲烷催化还原NOx.写出甲烷直接将NO2还原得到无污染的产物的化学方程式
(2)降低汽车尾气的方法之一是在排气管上安装催化 转化器,发生如下反应:
2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.
该反应的化学平衡常数表达式为K=
.
在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图1所示.
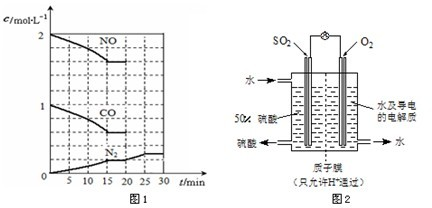
若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将
若20min时改变反应条件,导致N2浓度发生如图1所示的变化,则改变的条件可能是
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(3)最近,某科研单位研制成功一种处理SO2的方法:利用电化学原理将发电厂产生的大量SO2制成硫酸,装置如图2,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的
查看习题详情和答案>>
I.一种将CO2变为燃料或有机化学产品的构想分成3个步骤:
①利用浓碳酸钾溶液吸收空气中的CO2;
②将第①步吸收液电解产生H2和O2,同时分离出CO2;
③将第②步产生的H2(g)和CO2(g)在一定条件下转化成CH4(g)和H2O(l).
已知:H2(g)+
| 1 |
| 2 |
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2=-889.6kJ/mol
写出第③步反应的热化学方程式为
CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-253.6kJ/mol
CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-253.6kJ/mol
.II.目前,消除大气污染有多种方法.
(1)处理NOx的一种方法是利用甲烷催化还原NOx.写出甲烷直接将NO2还原得到无污染的产物的化学方程式
CH4+2NO2═N2+CO2+2H2O
CH4+2NO2═N2+CO2+2H2O
.(2)降低汽车尾气的方法之一是在排气管上安装催化 转化器,发生如下反应:
2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.
该反应的化学平衡常数表达式为K=
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图1所示.

若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将
不
不
移动(填“向左”、“向右”或“不”).若20min时改变反应条件,导致N2浓度发生如图1所示的变化,则改变的条件可能是
②
②
(填序号).①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(3)最近,某科研单位研制成功一种处理SO2的方法:利用电化学原理将发电厂产生的大量SO2制成硫酸,装置如图2,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的
负
负
极(填“正”或“负”),负极反应式为SO2-2e-+2H2O=4H++SO42-
SO2-2e-+2H2O=4H++SO42-
.用这种方法处理SO2废气的优点是可回收大量有效能,副产品为H2SO4,减少环境污染.