摘要:5.分子间作用力:(1)概念: . (2)影响因素: . (3)对物质性的影响: .
网址:http://m.1010jiajiao.com/timu_id_398890[举报]
有下列八种晶体:①金刚石 ②汞 ③氯化钾 ④二氧化硅 ⑤晶体碘 ⑥溴化钠 ⑦镁 ⑧二氧化碳.(填序号,下同)
其中属于金属晶体的是 ,属于原子晶体的是 ,
属于离子晶体的是 ,属于分子晶体的是 .
下列物质在所述变化过程中克服的是:①分子间作用力 ②共价键 ③离子键.
(1)冰融化 ,
(2)液溴挥发 ,
(3)食盐熔化 ,
(4)电解熔融MgCl2制Mg ,
(5)H2S受热分解成S和H2 .
查看习题详情和答案>>
其中属于金属晶体的是
属于离子晶体的是
下列物质在所述变化过程中克服的是:①分子间作用力 ②共价键 ③离子键.
(1)冰融化
(2)液溴挥发
(3)食盐熔化
(4)电解熔融MgCl2制Mg
(5)H2S受热分解成S和H2
 碳是形成化合物最多的元素.
碳是形成化合物最多的元素.(1)由碳元素参与形成的物质多为分子晶体,也有少数原子晶体.下列关于分子晶体和原子晶体的说法正确的是
A、完全由非金属元素形成的物质一定是分子晶体或原子晶体
B、分子晶体中分子之间一定存在范德华力
C、SiC具有极高的熔点和较大的硬度,SiC分子中除存在共价键外,还存在分子间作用力
D、金刚石是由碳元素形成的原子晶体,性质稳定,不与任何物质反应
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子.C4分子结构如图所示.下列说法正确的是
A、C4属于一种新型的化合物 B、C4与P4(白磷)的晶体都属于分子晶体
C、C4气体分子内含有极性共价键 D、C4与C60互为同素异形
(3)与碳同主族元素锗为32号元素,与锗同周期,且未成对电子数与锗相同,电负性最大的元素的价电子排布式为
(4)邻硝基苯酚的熔点
(5)硼、碳、氮、氧是元素周期表第二周期相邻的四种元素.下列有关的四种化合
物中,键角最小的是
A、CO2 B、CF4 C、NF3 D、OF2
已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却是一元酸,可以用硼酸在水溶液中的电离平衡解释它是一元弱酸的原因.
请写出下面这个方程式右端的两种离子的表达式:
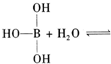 查看习题详情和答案>>
查看习题详情和答案>>
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是是同周期中非金属性最强的元素.
(1)X位于元素周期表的位置
第三周期、IA族
第三周期、IA族
,X与硫元素形成的化合物的电子式为

(2)Z的气态氢化物和溴化氢相比,较稳定的是
HCl
HCl
(写化学式).理由为氯元素的非金属性强于溴元素,所以HCl比HBr稳定
氯元素的非金属性强于溴元素,所以HCl比HBr稳定
.(3)Y与Z形成的化合物硬度小、熔点低、沸点低,其晶体中有存在的作用力有
范德华力(或分子间作用力)极性共价键(或共价键)
范德华力(或分子间作用力)极性共价键(或共价键)
其分子属于
非极性分子
非极性分子
(填极性分子、非极性分子),它和足量水反应,有白色胶状沉淀产生,该反应的化学方程式是SiCl4+3H2O=H2SiO3↓+4HCl或SiCl4+4H2O=H4SiO4↓+4HCl
SiCl4+3H2O=H2SiO3↓+4HCl或SiCl4+4H2O=H4SiO4↓+4HCl
.(4)在25°C、101kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol 电子放热190.0kJ,该反应的热化学方程式是
SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0kJ/mol
SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0kJ/mol
.下列说法或表示方法不正确的是( )
| A、燃料的燃烧反应都是放热反应 | B、绿色植物进行光合作用时,能把光能转化为化学能 | C、分子的热稳定性主要取决于分子内化学键的键能大小,与分子间作用力无关 | D、已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ?mol-1,则说明相同条件下,在密闭容器中,1 mol N2和3 mol H2混合充分反应后放热92.4 kJ |
(2009?辽宁)[化学-选修物质结构与性质]
已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.请回答下列问题:
(1)X元素原子基态时的电子排布式为
(2)Y元素原子的价层电子的轨道表示式为
 ,该元素的名称是
,该元素的名称是
(3)X与Z可形成化合物XZ3,该化合物的空间构型为
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由
查看习题详情和答案>>
已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.请回答下列问题:
(1)X元素原子基态时的电子排布式为
1s22s22p63s23p63d104s24p3
1s22s22p63s23p63d104s24p3
,该元素的符号是As
As
;(2)Y元素原子的价层电子的轨道表示式为


氧
氧
;(3)X与Z可形成化合物XZ3,该化合物的空间构型为
三角锥
三角锥
;(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O
As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O
;(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由
稳定性:NH3>PH3>AsH3因为键长越短,键能越大,化合物越稳定;沸点:NH3>AsH3>PH3;NH3可形成分子间氢键,沸点最高,AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3比PH3沸点高
稳定性:NH3>PH3>AsH3因为键长越短,键能越大,化合物越稳定;沸点:NH3>AsH3>PH3;NH3可形成分子间氢键,沸点最高,AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3比PH3沸点高
.