摘要:1.Br2是常温下唯一呈液态的非金属单质.易挥发.蒸气有毒.保存液溴 采用水封法.
网址:http://m.1010jiajiao.com/timu_id_398836[举报]
 (2011?锦州模拟)【化学--物质结构与性质】
(2011?锦州模拟)【化学--物质结构与性质】已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E的单质是常温下唯一呈液态的非金属.请回答下列问题:
(1)X、Y、Z第一电离能由小到大的顺序为
C
C
<O
O
<N
N
(填元素符号).(2)E元素基态原子的电子排布式为
1s22s22p63s23p63d104s24p5
1s22s22p63s23p63d104s24p5
.(3)XZ2分子中含有
2
2
个π键.(4)Z氢化物的沸点比Q氢化物的沸点高,理由是
氧元素的电负性很强,水分子之间存在氢键,导致熔沸点升高
氧元素的电负性很强,水分子之间存在氢键,导致熔沸点升高
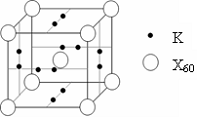
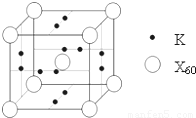
.(5)X元素可形成X60单质,它与金属钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示(白球位于立方体的体心和顶点,小黑球位于立方体的面上),该化合物中X60与钾原子个数比为
1:3
1:3
.
【化学--物质结构与性质】
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E的单质是常温下唯一呈液态的非金属.请回答下列问题:
(1)X、Y、Z第一电离能由小到大的顺序为 < < (填元素符号).
(2)E元素基态原子的电子排布式为 .
(3)XZ2分子中含有 个π键.
(4)Z氢化物的沸点比Q氢化物的沸点高,理由是 .
(5)X元素可形成X60单质,它与金属钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示(白球位于立方体的体心和顶点,小黑球位于立方体的面上),该化合物中X60与钾原子个数比为 .
 查看习题详情和答案>>
查看习题详情和答案>>
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E的单质是常温下唯一呈液态的非金属.请回答下列问题:
(1)X、Y、Z第一电离能由小到大的顺序为 < < (填元素符号).
(2)E元素基态原子的电子排布式为 .
(3)XZ2分子中含有 个π键.
(4)Z氢化物的沸点比Q氢化物的沸点高,理由是 .
(5)X元素可形成X60单质,它与金属钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示(白球位于立方体的体心和顶点,小黑球位于立方体的面上),该化合物中X60与钾原子个数比为 .
 查看习题详情和答案>>
查看习题详情和答案>>
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E的单质是常温下唯一呈液态的非金属。请回答下列问题:
(1)X、Y、Z第一电离能由小到大的顺序为 < < (填元素符号)。
(2)E元素基态原子的电子排布式为 。
(3)XZ2分子中含有 个π键。
|
(5)X元素可形成X60单质,它与金属钾掺杂在
一起制造了一种富勒烯化合物,其晶胞如图
所示(白球位于立方体的体心和顶点,小黑
球位于立方体的面上),该化合物中X60与钾
原子个数比为 。
查看习题详情和答案>>
如图是元素周期表的框架图,请根据下面提问回答下列问题:
(1)请在表中用实线补全元素周期表的边界.
(2)请用物质的名称填写.
硬度最大的是单质是 ,密度最小的金属是 ;通常状况呈液态的非金属单质是 ,地壳中含量最多的金属元素是 .
(3)在原子序数为1~18号元素中,请用化学式填写.
与水反应最剧烈的金属单质是 ;元素的气态氢化物最稳定的是 ;元素的最高价氧化物所对应的水化物其酸性最强的是 ;原子半径最大的金属与原子半径最小的非金属形成的化合物是 ,并用电子式表示其形成过程: .
(4)在原子序数为1~18号元素中,请按要求填写下列空白.
由两种元素组成的淡黄色化合物的电子式为 ;空气中含量最高的物质的结构式为 ;常温下为气态,固态常用于人工降雨的氧化物的电子式为 ;某元素最高价氧化物的水化物与其气态氢化物反应生成一种盐,该盐的化学式为 ,该化合物中的化学键类型是 . 查看习题详情和答案>>
(2)请用物质的名称填写.
硬度最大的是单质是 ,密度最小的金属是 ;通常状况呈液态的非金属单质是 ,地壳中含量最多的金属元素是 .
(3)在原子序数为1~18号元素中,请用化学式填写.
与水反应最剧烈的金属单质是 ;元素的气态氢化物最稳定的是 ;元素的最高价氧化物所对应的水化物其酸性最强的是 ;原子半径最大的金属与原子半径最小的非金属形成的化合物是 ,并用电子式表示其形成过程: .
(4)在原子序数为1~18号元素中,请按要求填写下列空白.
由两种元素组成的淡黄色化合物的电子式为 ;空气中含量最高的物质的结构式为 ;常温下为气态,固态常用于人工降雨的氧化物的电子式为 ;某元素最高价氧化物的水化物与其气态氢化物反应生成一种盐,该盐的化学式为 ,该化合物中的化学键类型是 . 查看习题详情和答案>>
A、B、C、D、E五种主族元素分属于三个短周期,且原子序数依次增大.A、C同主族,可形成离子化合物CA;B、D同主族,可形成DB2、DB,两种分子.请回答下列问题:
(1)E在元素周期表中的位置是
(2)A、B两种元素能形成两种常温下均呈液态的化合物M、N,具有强氧化性的化合物M的电子式可表示为
 ;化合物N具有较高的沸点,原因是
;化合物N具有较高的沸点,原因是
(3)在上述元素最高价氧化物对应的水化物中酸性最强的是
(4)A、B、C、D中的三种或四种元素能形成多种离子化合物,其水溶液呈碱性的有
(5)B、E的单质或由两元素形成的化合物牛可作消毒剂的有
查看习题详情和答案>>
(1)E在元素周期表中的位置是
第三周期ⅦA族
第三周期ⅦA族
,其核外电子排布式为1s22s22p63s23p5
1s22s22p63s23p5
,五种元素的原子半径由小到大的顺序为H<O<Cl<S<Na
H<O<Cl<S<Na
(用元素符号回答).(2)A、B两种元素能形成两种常温下均呈液态的化合物M、N,具有强氧化性的化合物M的电子式可表示为


水分子间存在氢键
水分子间存在氢键
.(3)在上述元素最高价氧化物对应的水化物中酸性最强的是
HClO4
HClO4
(写化学式,下同),非金属气态氢化物还原性最强的是H2S
H2S
.(4)A、B、C、D中的三种或四种元素能形成多种离子化合物,其水溶液呈碱性的有
NaOH、Na2SO3
NaOH、Na2SO3
(任写两种化合物,用化学式表示,下同).(5)B、E的单质或由两元素形成的化合物牛可作消毒剂的有
O3、Cl2、ClO2
O3、Cl2、ClO2
.