网址:http://m.1010jiajiao.com/timu_id_386625[举报]
(1)三种弱酸HA、H2B、HC,电离常数为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
①HA+HB-(少量)=A-+H2B ②H2B(少量)+C-=HB-+HC
③HA(少量)+C-=A-+HC
若H2B的Ka1=4.3×10-7,则另二种酸对应的电离常数分别为(根据已知数据填
空):HA的Ka= ,HC的Ka= 。
(2)25 ℃时0.1 mol·L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、
HR-、R2-三种微粒的溶液。当c(Na+)=c(R2-)+c(HR-)+c(H2R)时溶液的溶质
为 (填化学式)。
(3)下图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。

①下列叙述正确的是 。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
②已知Ksp(CaCO3)=5.0×10-9,在10 mL 0.02 mol·L-1的Na2CO3溶液中,加入某浓度的盐酸,调节溶液的pH=10.25,此时溶液的体积恰好为100 mL,向该溶液中加入1 mL 1×10-4 mol·L-1的CaCl2溶液,问是否有沉淀生成? (填“是”或“否”)。
查看习题详情和答案>>
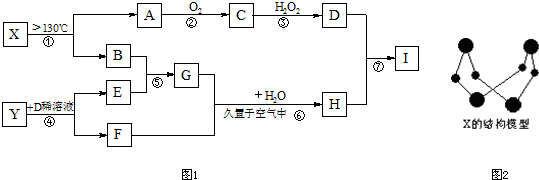
试回答下列问题
(1)写出X的化学式:
(2)写出G的电子式:
(3)写出反应③的化学方程式
(4)写出C和I溶液反应生成F的离子方程式
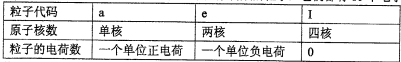
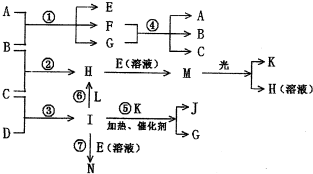
物质A由a、e构成,B、C、D、K都是单质,各有关物质之间的相互反应转化关系如下图所示,反应①-⑤都是用于工业生产的反应,⑥、⑦反应中个别产物在图中略去.
请填写下列空白:
(1)a的结构示意图:


(2)写出下列反应的离子反应方程式:
H+E(溶液)→M
| ||
| ||
(3)E(溶液)能与I以1:2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,写出该反应的化学方程式
(4)L是由3种元素构成的分子,能与I以1:2的物质的量之比反应生成尿素CO(NH2)2和物质H,写出L的电子式


(5)反应③用于工业生产时应在
所使用的一种特殊材料的名称为
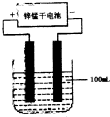
(6)常温下,实验室模拟工业反应④的过程如图所示,标况下,当电极上产生 112ml(已折算为标准状况下的体积)B气体时,烧杯中溶液的pH=

①如图1,在稀碱溶液中,溴苯难发生水解
②如图2,现有分子式为C10H10O2Br2的芳香族化合物X,其苯环上的一溴代物只有一种,其核磁共振氢谱图中有四个吸收峰,吸收峰的面积比为1:2:6:1,在一定条件下可发生下述一系列反应,其中C能发生银镜反应,E遇FeCl3溶液显色且能与浓溴水反应.
请回答下列问题:
(1)X中官能的名称是
(2)F→H的反应类型是
(3)I的结构简式为
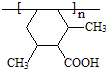

(4)E不具有的化学性质
a.取代反应 b.消去反应 c.氧化反应 d.1molE最多能与2molNaHCO3反应
(5)写出下列反应的化学方程式:
①X与足量稀NaOH溶液共热的化学方程式:


②F→G的化学方程式:


(6)同时符合下列条件的E的同分异构体共有


a.苯环上核磁共振氢谱有两种 b.不能发生水解反应
c.遇FeCl3溶液不显色 d.1molE最多能分别与1molNaOH和2molNa反应.