摘要:答案: (1)124.2. (2)C3H8+5O2===3CO2+4H2O,负.
网址:http://m.1010jiajiao.com/timu_id_386566[举报]
(2012?闵行区二模)硫铁矿石(主要成分FeS2)用于工业制硫酸,其排出的矿渣在一定条件下以磁性氧化铁为主.经磁选获得精矿,可直接用于高炉炼铁.已知某精矿的主要成分是磁性氧化铁( Fe3O4)和Fe2O3及杂质(杂质不含铁、硫、氧元素,且杂质不耗氧).请回答下列问题:
(1)某硫铁矿石中(杂质不含铁、硫)含硫的质量分数是0.360,则该硫铁矿石中含铁元素的质量分数是
(2)如用上述硫铁矿石制硫酸,矿渣经磁选获得精矿,直接用于高炉炼铁,当制得98.0%的硫酸1.92吨时(不考虑硫的损失),则炼铁厂(不计选矿及炼铁时铁的损耗)最多可生产含碳4.00%的生铁
(3)煅烧硫铁矿常用富氧空气.从沸腾炉排出的气体成分如下表.如果精矿中铁、氧的物质的量之比为n (Fe):n(O)=5:7,则富氧空气中O2和N2的体积比(最简单的整数比)为
(4)炼铁厂生产的生铁常用于炼钢.取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况下).
A计算此钢样粉末中铁和碳的物质的量之比为
B再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
则该硫酸溶液的物质的量浓度为
C若在上述实验II中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少?(写出必要的步骤,答案保留3位小数).
查看习题详情和答案>>
(1)某硫铁矿石中(杂质不含铁、硫)含硫的质量分数是0.360,则该硫铁矿石中含铁元素的质量分数是
0.315
0.315
(答案用小数表示,保留3位小数).(2)如用上述硫铁矿石制硫酸,矿渣经磁选获得精矿,直接用于高炉炼铁,当制得98.0%的硫酸1.92吨时(不考虑硫的损失),则炼铁厂(不计选矿及炼铁时铁的损耗)最多可生产含碳4.00%的生铁
0.560
0.560
吨(答案保留3位小数).(3)煅烧硫铁矿常用富氧空气.从沸腾炉排出的气体成分如下表.如果精矿中铁、氧的物质的量之比为n (Fe):n(O)=5:7,则富氧空气中O2和N2的体积比(最简单的整数比)为
39:116
39:116
.| 气体 | SO2 | N2 | O2 |
| 物质的量 | 10 | 58 | 6 |
A计算此钢样粉末中铁和碳的物质的量之比为
50:1
50:1
(最简单的整数比).B再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
| 生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
1.25 mol/L
1.25 mol/L
.C若在上述实验II中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少?(写出必要的步骤,答案保留3位小数).
 (2012?江苏一模)在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.
(2012?江苏一模)在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.★乙酸正丁酯的制备
在干燥的50mL圆底烧瓶中,加入11.5mL(0.125mol)正丁醇和7.2mL(0.125mol)冰醋酸,再加入3~4滴浓硫酸,摇匀,投入1~2粒沸石.按图安装带分水器的回流反应装置,并在分水器中预先加入水,使水面略低于分水器的支管口.
打开冷凝水,圆底烧瓶在石棉网上用小火加热.在反应过程中,通过分水器下部的旋塞分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中.反应达到终点后,停止加热,记录分出的水的体积.
★产品的精制
将分水器分出的酯层和反应液一起倒入分液漏斗中,用10mL水洗涤.有机层继续用10mL10%Na2CO3洗涤至中性,再用10mL 的水洗涤,最后将有机层倒入锥形瓶中,再用无水硫酸镁干燥.将干燥后的乙酸正丁酯滤入50mL 烧瓶中,常压蒸馏,收集124~126℃的馏分,得11.34g产品.
(1)冷水应该从冷凝管
a
a
(填a或b)管口通入.(2)判断反应终点的依据是:
分水器中的水层不再增加时,视为反应的终点
分水器中的水层不再增加时,视为反应的终点
.(3)本实验提高产品产率的方法是
使用分水器分离酯化反应生成的水,使平衡正向移动,提高反应产率
使用分水器分离酯化反应生成的水,使平衡正向移动,提高反应产率
.(4)产品的精制过程中,第一次水洗的目的是
除去乙酸及少量的正丁醇
除去乙酸及少量的正丁醇
,第二次水洗的目的是除去溶于酯中的少量无机盐
除去溶于酯中的少量无机盐
.洗涤完成后将有机层从分液漏斗的上端
上端
置入锥形瓶中.(5)该实验过程中,生成乙酸正丁酯的产率是
78.4%
78.4%
. 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:(1)该浓盐酸中HCL的物质的量浓度为
11.9
11.9
mol?L-1.(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是
BD
BD
.(有1~2个答案)A、溶液中HCL的物质的量 B、溶液的浓度
C、溶液中CL-的数目 D、溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500ml 物质的量浓度为0.400mol?L-1的稀盐酸.
①该学生需要量取
16.8
16.8
ml 上述浓盐酸进行配制.②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”).
I、用量筒量取浓盐酸进俯视观察凹液面
B
B
.II、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
B
B
.(2011?宣城二模)镁及其化合物在生产生活中有重要的作用.以水氯镁石(主要成分为MgCl2?6H2O)为原料生产碱式碳酸镁的主要流程如下:
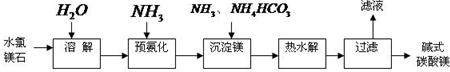
(1)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为
(2)写出预氨化时发生的主要反应的离子方程式:
(3)沉淀镁时反应的温度不宜过高,原因是
(4)设计一个实验,确定产品碱式碳酸镁aMgCO3?bMg(OH)2?cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量;②高温分解;③
(5)从水氯镁石中可以提取无水氯化镁,电解熔融态的无水氯化镁可以得到金属镁.有同学认为:电解熔融的MgO也可制金属镁,在实际生产中可简化生产步骤,体现生产的简约性和经济性原则.你同意该同学的想法吗?为什么?你的观点是
查看习题详情和答案>>

(1)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为
NH4Cl
NH4Cl
.指出该物质在工农业生产中的一种用途:做氮肥(或其他合理答案)
做氮肥(或其他合理答案)
.(2)写出预氨化时发生的主要反应的离子方程式:
Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+
Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+
.(3)沉淀镁时反应的温度不宜过高,原因是
防止碳酸氢铵分解
防止碳酸氢铵分解
.(4)设计一个实验,确定产品碱式碳酸镁aMgCO3?bMg(OH)2?cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量;②高温分解;③
测出CO2的质量
测出CO2的质量
;④测出水蒸气的质量
测出水蒸气的质量
;⑤称量MgO.18.2g产品完全分解后,产生6.6g CO2和8.0g MgO,由此可知,产品的化学式中:a=3
3
;b=1
1
;c=3
3
.(5)从水氯镁石中可以提取无水氯化镁,电解熔融态的无水氯化镁可以得到金属镁.有同学认为:电解熔融的MgO也可制金属镁,在实际生产中可简化生产步骤,体现生产的简约性和经济性原则.你同意该同学的想法吗?为什么?你的观点是
不同意
不同意
.理由是因为MgO熔点很高,熔融时耗费大量的能量而增加生产成本
因为MgO熔点很高,熔融时耗费大量的能量而增加生产成本
.盐泥是氯碱工业中的废渣,主要含有镁、铁、铝、钙等的硅酸盐和碳酸盐.实验室以盐泥为原料制取MgSO4?7H2O的实验过程如下:

已知:①Ksp[Mg(OH)2]=6.0×10-12.②Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为:7.1~9.6、2.0~3.7、3.1~4.7.③三种化合物的溶解度(S)随温度变化的曲线如下图所示.

(1)在盐泥中加入稀硫酸调pH为1~2以及第一次煮沸的目的是
(2)若溶液中Mg2+的浓度为6.0mol?L-1,则溶液pH≥
(3)第二次过滤需要趁热进行,主要原因是
(4)从滤液Ⅱ中获得MgSO4?7H2O晶体的实验步骤依次为:①向滤液Ⅱ中加入
(5)若获得的MgSO4?7H2O的质量为24.6g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为
查看习题详情和答案>>

已知:①Ksp[Mg(OH)2]=6.0×10-12.②Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为:7.1~9.6、2.0~3.7、3.1~4.7.③三种化合物的溶解度(S)随温度变化的曲线如下图所示.

(1)在盐泥中加入稀硫酸调pH为1~2以及第一次煮沸的目的是
提高Mg2+的浸取率
提高Mg2+的浸取率
(2)若溶液中Mg2+的浓度为6.0mol?L-1,则溶液pH≥
8
8
才可能产生Mg(OH)2沉淀.(3)第二次过滤需要趁热进行,主要原因是
温度较高时钙盐与镁盐分离得更彻底(或高温下CaSO4?2H2O溶解度小等合理答案均可)
温度较高时钙盐与镁盐分离得更彻底(或高温下CaSO4?2H2O溶解度小等合理答案均可)
,所得滤渣的主要成分是Al(OH)3、Fe(OH)3、CaSO4?2H2O
Al(OH)3、Fe(OH)3、CaSO4?2H2O
.(4)从滤液Ⅱ中获得MgSO4?7H2O晶体的实验步骤依次为:①向滤液Ⅱ中加入
NaOH溶液
NaOH溶液
;②过滤,得沉淀;③向沉淀中加足量稀硫酸
向沉淀中加足量稀硫酸
;④蒸发浓缩,降温结晶;⑤过滤、洗涤得产品.(5)若获得的MgSO4?7H2O的质量为24.6g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为
20.0%
20.0%
(MgSO4?7H2O的相对分子质量为246).