网址:http://m.1010jiajiao.com/timu_id_356361[举报]
(1)(19分)①研究性学习小组为了证明铁的金属性比铜强,他设计了如下几种方案,其中合理的是 (填序号)
A.铁片置于硫酸铜溶液中有铜析出;
B.铁、铜与氯气反应分别生成FeCl3、CuCl2;
C.铜片置于FeCl3溶液中,铜片逐渐溶解(2FeCl3+Cu=2FeCl2+ CuCl2)
D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡
E.常温下,分别将铁片和铜片置于浓硝酸中,铁片不溶解,而铜片溶解
②请你另设计一个能证明铁的金属活动性比铜强的实验。要求:
a.此方案的原理不同于上述任一合理方案;
b.在方框内绘出实验装置图并注明所需的药品;
c.写出实验过程中的主要实验现象并用相关化学用语解释现象

(2)学完原电池的相关知识后,甲组同学认为构成原电池必须有三个条件:①活动性不同的两极;②电解质溶液;③闭合回路。乙组同学对条件①提出异议,认为相同的两极也可以构成原电池,以下为乙组同学的实验装置简图以及实验报告的部分内容。请仔细阅读实验报告,然后将实验报告补充完整并填在相应的横线上。装置中盐桥的作用之一是使整个装置构成闭合回路。

浓差电池与温差电池
一、【实验目的】
1、电池中两杯溶液及电极均相同,两杯溶液的浓度不同,可否形成原电池
2、电池中两杯溶液及电极均相同,两杯溶液的温度不同,可否形成原电池
3、电池中两杯溶液及电极均相同,研究两杯溶液的 对电池电压和电流的影响
4、电池中两杯溶液及电极均相同,研究两杯溶液的 对电池电压和电流的影响
二、【仪器与药品】略。
三、【实验方法与步骤】
Ⅰ、实验方法:略。
Ⅱ、研究的步骤
㈠实验A:浓差电池
电解液均为硫酸铜,电极均为铜片:
1、甲烧杯中固定装入浓度 0.8 mol/L 的硫酸铜溶液。
2、乙烧杯中分別装入浓度 0.8 mol/L、0.4 mol/L 、0.2 mol/L、0.1 mol/L、0.05 mol/L、0.025 mol/L 的硫酸铜溶液。
3、使用铜片当电极。测量这六种组合电池的稳定电压及电流,将结果记录于表 1。
㈡实验B:温差电池
电解液均为硫酸铜,电极均为铜片:(步骤略,结果记录于表2)
四、【实验结果】
实验A:浓差电池 :表1
|
甲杯硫酸铜浓度 mol/L |
0.8 |
0.8 |
0.8 |
0.8 |
0.8 |
0.8 |
|
乙杯硫酸铜浓度 mol/L |
0.8 |
0.4 |
0.2 |
0.1 |
0.05 |
0.025 |
|
两杯溶液浓度差值 |
0 |
0.4 |
0.6 |
0.7 |
0.75 |
0.775 |
|
电压 mV |
0 |
6 |
12 |
16 |
22 |
26 |
|
电流 mA |
0 |
0.02 |
0.04 |
0.06 |
0.07 |
0.08 |
实验B:温差电池:表2
|
甲杯硫酸铜温度℃ |
19 |
19 |
19 |
19 |
19 |
19 |
|
乙杯硫酸铜温度℃ |
19 |
29 |
39 |
49 |
59 |
69 |
|
两杯溶液温差℃ |
0 |
10 |
20 |
30 |
40 |
50 |
|
电压 mV |
0 |
6.1 |
12 |
20[来源:] |
27 |
34 |
|
电流 mA |
0 |
0.025 |
0.047 |
0.07 |
0.15 |
0.18 |
五、【讨论】
1、浓差电池:若硫酸铜浓差电池放电较长一段时间后,可观察到甲杯高浓度的溶液颜色逐渐变浅,而乙杯颜色变深,而电压也逐渐下降,同时可观察到甲杯中铜片表面有铜析出。
这说明:甲杯中的电极反应式为
乙杯中的电极反应式为
电池放电一段较长时间后电压下降的原因:
2、温差电池(略)
六、【结论】
由上述【实验结果】可得结论:
实验A: [来源:学&科&网Z&X&X&K]
实验B:(略)
甲、乙两小组同学给你什么启示:
查看习题详情和答案>>
(1)(19分)①研究性学习小组为了证明铁的金属性比铜强,他设计了如下几种方案,其中合理的是 (填序号)
A.铁片置于硫酸铜溶液中有铜析出;
B.铁、铜与氯气反应分别生成FeCl3、CuCl2;
C.铜片置于FeCl3溶液中,铜片逐渐溶解(2FeCl3+Cu=2FeCl2+ CuCl2)
D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡
E.常温下,分别将铁片和铜片置于浓硝酸中,铁片不溶解,而铜片溶解
②请你另设计一个能证明铁的金属活动性比铜强的实验。要求:
a.此方案的原理不同于上述任一合理方案;
b.在方框内绘出实验装置图并注明所需的药品;
c.写出实验过程中的主要实验现象并用相关化学用语解释现象
(2)学完原电池的相关知识后,甲组同学认为构成原电池必须有三个条件:①活动性不同的两极;②电解质溶液;③闭合回路。乙组同学对条件①提出异议,认为相同的两极也可以构成原电池,以下为乙组同学的实验装置简图以及实验报告的部分内容。请仔细阅读实验报告,然后将实验报告补充完整并填在相应的横线上。装置中盐桥的作用之一是使整个装置构成闭合回路。
浓差电池与温差电池
一、【实验目的】
1、电池中两杯溶液及电极均相同,两杯溶液的浓度不同,可否形成原电池
2、电池中两杯溶液及电极均相同,两杯溶液的温度不同,可否形成原电池
3、电池中两杯溶液及电极均相同,研究两杯溶液的 对电池电压和电流的影响
4、电池中两杯溶液及电极均相同,研究两杯溶液的 对电池电压和电流的影响
二、【仪器与药品】略。
三、【实验方法与步骤】
Ⅰ、实验方法:略。
Ⅱ、研究的步骤
㈠实验A:浓差电池
电解液均为硫酸铜,电极均为铜片:
1、甲烧杯中固定装入浓度 0.8 mol/L 的硫酸铜溶液。
2、乙烧杯中分別装入浓度 0.8 mol/L、0.4 mol/L 、0.2 mol/L、0.1 mol/L、0.05 mol/L、0.025 mol/L 的硫酸铜溶液。
3、使用铜片当电极。测量这六种组合电池的稳定电压及电流,将结果记录于表 1。
㈡实验B:温差电池
电解液均为硫酸铜,电极均为铜片:(步骤略,结果记录于表2)
四、【实验结果】
实验A:浓差电池 :表1
| 甲杯硫酸铜浓度 mol/L | 0.8 | 0.8 | 0.8 | 0.8 | 0.8 | 0.8 |
| 乙杯硫酸铜浓度 mol/L | 0.8 | 0.4 | 0.2 | 0.1 | 0.05 | 0.025 |
| 两杯溶液浓度差值 | 0 | 0.4 | 0.6 | 0.7 | 0.75 | 0.775 |
| 电压 mV | 0 | 6 | 12 | 16 | 22 | 26 |
| 电流 mA | 0 | 0.02 | 0.04 | 0.06 | 0.07 | 0.08 |
实验B:温差电池:表2
| 甲杯硫酸铜温度℃ | 19 | 19 | 19 | 19 | 19 | 19 |
| 乙杯硫酸铜温度℃ | 19 | 29 | 39 | 49 | 59 | 69 |
| 两杯溶液温差℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 电压 mV | 0 | 6.1 | 12 | 20 | 27 | 34 |
| 电流 mA | 0 | 0.025 | 0.047 | 0.07 | 0.15 | 0.18 |
五、【讨论】
1、浓差电池:若硫酸铜浓差电池放电较长一段时间后,可观察到甲杯高浓度的溶液颜色逐渐变浅,而乙杯颜色变深,而电压也逐渐下降,同时可观察到甲杯中铜片表面有铜析出。
这说明:甲杯中的电极反应式为
乙杯中的电极反应式为
电池放电一段较长时间后电压下降的原因:
2、温差电池(略)
六、【结论】
由上述【实验结果】可得结论:
实验A: [来源:学&科&网Z&X&X&K]
实验B:(略)
甲、乙两小组同学给你什么启示:
查看习题详情和答案>>
(10分)A、B、C、D四种元素的原子序数均小于18,其最高正价数依次为1,4,5,7,已知B的原子核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应的水化物是已知含氧酸中最强酸,则:
(1)A的离子结构示意图是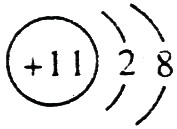 ,C的原子结构示意图是
,C的原子结构示意图是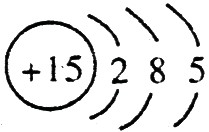 。
。
(2)C的最高价氧化物对应的水化物与A的氢氧化物生成三种盐,化学式分别为Na3PO4、Na2HPO4、NaH2PO4。
(3)C、D的气态氢化物稳定性由强到弱的顺序是 HCl>PH3。
【解析】 最高正价=原子最外层电子数,B元素的原子最外层电子数应为4,B元素原子的次外层电子数为2,为K层,B元素原子核外共有2+4=6个电子,B是6号元素碳;A、C原子次外层电子数为8,则A、C原子核外电子数分别是:2+8+1=11和2+8+5=15,所以A为11号元素钠,C为15号元素磷;在1~18号元素中,最高价为+7的只有氯元素(F无正价),而HClO4是已知含氧酸中最强的酸,故D为氯。
(1)钠总是+1价,其离子结构示意图为: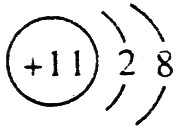 ;磷的原子序数是15,其原子结构示意图是:
;磷的原子序数是15,其原子结构示意图是: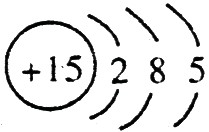 。
。
(2)磷的最高价(+5)氧化物对应的水化物是H3PO4,与NaOH反应生成:Na3PO4、NaH2PO4三种盐。
(3)P、Cl原子都具有3个电子层,核电荷数P(15)小于Cl(17),原子半径r(P)>r(Cl),所以非金属Cl>P,气态氢化物稳定性HCl>PH3。
查看习题详情和答案>>右图为农夫山泉矿泉水瓶上的部分说明文字,列出了该饮用天然水理化指标。这里的钙、镁、钾、钠是指
|
饮用天然水理化指标 矿物元素 测定结果 钙≥4.0 mg/L 镁≥0.5 mg/L 钾≥0.35 mg/L 钠≥0.8 mg/L 偏硅酸≥1.8 mg/L pH (25℃) 7.1
【答案】D 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】农夫山泉,指标 【结束】 3【题文】下列实验操作中,错误的是
【答案】D 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】实验操作 【结束】 4【题文】下列说法中正确的是
【答案】B 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】分子数,原子数 【结束】 5【题文】下列有关0.2mol·L-1 BaCl2溶液的说法不正确的是
【答案】A 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】溶液,离子浓度 【结束】 6【题文】下列离子方程式中书写正确的是( )
【答案】B 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】离子方程式,氢氧化钡 【结束】 7【题文】已知有如下反应:①2Fe3++2I-===2Fe2++I2 ②2Fe2++Br2===2Fe3++2Br- ③2Fe(CN)+I2===2Fe(CN)+2I-,试判断氧化性强弱顺序正确的是
【答案】C 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】氧化性,顺序 【结束】 8【题文】实验室制取少量N2常利用的反应是NaNO2+NH4ClNaCl+N2↑+2H2O,关于该反应的说法正确的是
【答案】A 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】实验室,氧化剂 【结束】 9【题文】用托盘天平称量固体物质时,若将样品和砝码放在托盘上的位置颠倒,平衡时托盘上的砝码质量为10g,游码为0.5g,则样品的质量为
【答案】D 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】托盘天平,砝码 【结束】 10【题文】将26克含有SiO2和CaCO3固体在高温下加热至质量不再改变,冷却后称重为17.2克。(已知:SiO2 + CaCO3 CaSiO3 + CO2↑,SiO2和CaSiO3均为固体) (1)求生成的CO2的体积(标准状况下) (2)求原混合物中所含SiO2的质量。 【答案】(1)4.48L (2)6克 【解析】略 【题型】计算题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】高温,体积 【结束】 |
查看习题详情和答案>>
右图为农夫山泉矿泉水瓶上的部分说明文字,列出了该饮用天然水理化指标。这里的钙、镁、钾、钠是指
|
饮用天然水理化指标 矿物元素 测定结果 钙≥4.0 mg/L 镁≥0.5 mg/L 钾≥0.35 mg/L 钠≥0.8 mg/L 偏硅酸≥1.8 mg/L pH (25℃) 7.1
【答案】D 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】农夫山泉,指标 【结束】 3【题文】下列实验操作中,错误的是
【答案】D 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】实验操作 【结束】 4【题文】下列说法中正确的是
【答案】B 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】分子数,原子数 【结束】 5【题文】下列有关0.2mol·L-1 BaCl2溶液的说法不正确的是
【答案】A 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】溶液,离子浓度 【结束】 6【题文】下列离子方程式中书写正确的是( )
【答案】B 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】离子方程式,氢氧化钡 【结束】 7【题文】已知有如下反应:①2Fe3++2I-===2Fe2++I2 ②2Fe2++Br2===2Fe3++2Br- ③2Fe(CN)+I2===2Fe(CN)+2I-,试判断氧化性强弱顺序正确的是
【答案】C 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】氧化性,顺序 【结束】 8【题文】实验室制取少量N2常利用的反应是NaNO2+NH4ClNaCl+N2↑+2H2O,关于该反应的说法正确的是
【答案】A 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】实验室,氧化剂 【结束】 9【题文】用托盘天平称量固体物质时,若将样品和砝码放在托盘上的位置颠倒,平衡时托盘上的砝码质量为10g,游码为0.5g,则样品的质量为
【答案】D 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】托盘天平,砝码 【结束】 10【题文】将26克含有SiO2和CaCO3固体在高温下加热至质量不再改变,冷却后称重为17.2克。(已知:SiO2 + CaCO3 CaSiO3 + CO2↑,SiO2和CaSiO3均为固体) (1)求生成的CO2的体积(标准状况下) (2)求原混合物中所含SiO2的质量。 【答案】(1)4.48L (2)6克 【解析】略 【题型】计算题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】高温,体积 【结束】 |
查看习题详情和答案>>