网址:http://m.1010jiajiao.com/timu_id_317220[举报]
A卷
1.C 2.B 3.C 4.B 5.B 6.C 7.B 8.A 9.B 10.A 11.A 12.C 13.C 14.B 15.B
16. ①Fe3++3H2O Fe(OH)3+3H+
②2Fe3++Fe=3Fe2+
③Fe3++SCN…=[Fe(SCN)]2+
Fe(OH)3+3H+
②2Fe3++Fe=3Fe2+
③Fe3++SCN…=[Fe(SCN)]2+
④Fe3++3NH3?H2O=Fe(OH)3+3NH4+ ⑤2Fe3++H2S=2Fe2++S↓+2H+(每个2分)
17. CH3OCH3+16OH--12e-=2CO32 -+11H2O;3O2+6H2O+12e-===12OH-;CH3OCH3+4OH-+3O2=2CO32 -+5H2O(每个2分)
18. (1)① Mg2+、SO42−、H+ ②Ba2+、NO3−、OH−;(全对给2分,答不全但答到H+ 或OH−得1分)
19. (1)0.2 mol(1分)(2)SO2、NO2(1分) (3)AC(全对给2分,答不全得1分)
20. (1)H2(1分)(2)①Fe+2H+=Fe2++H2↑②AlO2-+4H+=Al3++2H2O
③4Fe2++8NH3?H2O+O2+2H2O=4Fe(OH)3↓+8NH4+或:Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+、 4Fe(OH)2+O2+2H2O=4Fe(OH)3(每个2分)
(3) Al3+和Na+(全对给2分,答不全得1分) (4) H2SO4、HNO3(全对给2分,不全得1分)
21. (1)ECDBAGF(2分);酚酞(1分);无色变为浅红色(或粉红色)且半分钟不褪去(2分);
(2)偏大(1分)(3)100.00mL容量瓶(1分)(4)偏小 偏小 偏大(每个1分)
(5)4.20mol/L(2分)
22. (1) 7g;8g;(2) 3.5mol/L
B卷
B卷:23.C 24.D 25.C 26.B 27.B 28.C 29.D 30.C
31.(1)3.6 mol (2)≥0(说明:答“任意值”可得分)(3)3.6 mol< n(SO3)≤4 mol(每个2分)
32. (1)NH4C1、① ;(2)NH4Cl和NH3?H2O(答NH4Cl和NH3也给分);NH4Cl和HCl;
(3)小于 大于;(每个1分)
33. (1)将Fe3+ 还原为Fe2+;析出(或分离、或得到)FeSO4?7H2O;(每个2分)
(2) FeSO4?7H2O 石灰(或碳酸钙、废碱);(每个1分)
 (3)TiO2+2C+2Cl2 TiCl4+2CO(2分);CO(1分);①TiCl4+2Mg△ㄔㄔTi+2MgCl2(2分);②防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用(2分)③加入足量盐酸,除去金属镁,过滤,并用蒸馏水洗涤固体得金属钛。(2分)
(3)TiO2+2C+2Cl2 TiCl4+2CO(2分);CO(1分);①TiCl4+2Mg△ㄔㄔTi+2MgCl2(2分);②防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用(2分)③加入足量盐酸,除去金属镁,过滤,并用蒸馏水洗涤固体得金属钛。(2分)
34. (1)0.6 mol/L (2分);(2)97.5mL(2分);(3)35mL(3分)
(1)该学生用标准0.14mol/L NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂.
B.用待测定的溶液润洗酸式滴定管. C.用蒸馏水洗干净滴定管.
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下. E.检查滴定管是否漏水. F.另取锥形瓶,再重复操作一次. G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度.
a、滴定操作的正确顺序是(用序号填写):
b、该滴定操作中应选用的指示剂是:
c、在G操作中如何确定终点?
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”)
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果精确到小数点后二位)
(1)若使用甲基橙做指示剂,如何确定终点
(2)下列操作将导致测定值高于实际值的是
A.标准液在“0”刻度线以上,未予调整就开始滴定
B.碱式滴定管用蒸馏水洗涤后未用标准NaOH溶液润洗
C.观察记录滴定管内液面刻度时滴定前仰视,滴定后俯视
D.酸滴定管经蒸馏水洗净后,即注入锥形瓶进行中和滴定
E.在滴定过程中不慎将数滴酸液滴在锥形瓶外
(3)计算待测硫酸溶液的物质的量浓度为
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL(酚酞作指示剂),滴定终止时消耗NaOH溶液15.00mL。
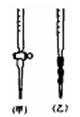
(1)该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
A、用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,滴入指示剂。
B、用待测定的溶液润洗酸式滴定管
C、用蒸馏水洗干净滴定管
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”
以上2—3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E、检查滴定管是否漏水
F、另取锥形瓶,再重复操作一次
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写);E→C→D→ → → →F;
②在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果
(填“偏小”、“偏大”或“不变”)。
(3)如有1mol/L和0.1mol/L的NaOH溶液,应用0.1mol/L的NaOH溶液,原因是______________ _____ ___。
(4)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 __(选填“甲”或“乙”)中。
(5)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度 (选填“偏大”“偏小”或“无影响”)
(6)计算待测硫酸(稀释前的硫酸)的物质的量浓度(保留到小数点后二位) 。
查看习题详情和答案>>(11分)某学生为测定未知浓度的硫酸溶液,实验如下:以0.14mol/L的NaOH溶液滴定上述稀H2SO420.00mL,滴定终止时消耗NaOH溶液16.00mL。
(1)该学生用标准0.14 mol/LNaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO420.00 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。
C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写): E—( )—D—( )— ( )—( )—F 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终点? 。
(2)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是_________。
A.配制标准溶液的氢氧化钠中混有NaCl杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
F.开始实验时碱式滴定管尖嘴部分有气泡,在滴定过程中气泡消失,则测得盐酸浓度
(3)计算待测硫酸溶液的物质的量浓度 mol/L(计算结果保留二位有效数字)
查看习题详情和答案>>
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL(酚酞作指示剂),滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
A、用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,滴入指示剂。
B、用待测定的溶液润洗酸式滴定管
C、用蒸馏水洗干净滴定管
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”
以上2—3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E、检查滴定管是否漏水
F、另取锥形瓶,再重复操作一次
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写);E→C→D→ → → →F;
②在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果
(填“偏小”、“偏大”或“不变”)。
(3)如有1mol/L和0.1mol/L的NaOH溶液,应用0.1mol/L的NaOH溶液,原因是______________ _____ ___。
(4)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 __(选填“甲”或“乙”)中。
(5)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度 (选填“偏大”“偏小”或“无影响”)
(6)计算待测硫酸(稀释前的硫酸)的物质的量浓度(保留到小数点后二位) 。
查看习题详情和答案>>