网址:http://m.1010jiajiao.com/timu_id_317210[举报]
A卷
1.C 2.B 3.C 4.B 5.B 6.C 7.B 8.A 9.B 10.A 11.A 12.C 13.C 14.B 15.B
16. ①Fe3++3H2O Fe(OH)3+3H+
②2Fe3++Fe=3Fe2+
③Fe3++SCN…=[Fe(SCN)]2+
Fe(OH)3+3H+
②2Fe3++Fe=3Fe2+
③Fe3++SCN…=[Fe(SCN)]2+
④Fe3++3NH3?H2O=Fe(OH)3+3NH4+ ⑤2Fe3++H2S=2Fe2++S↓+2H+(每个2分)
17. CH3OCH3+16OH--12e-=2CO32 -+11H2O;3O2+6H2O+12e-===12OH-;CH3OCH3+4OH-+3O2=2CO32 -+5H2O(每个2分)
18. (1)① Mg2+、SO42−、H+ ②Ba2+、NO3−、OH−;(全对给2分,答不全但答到H+ 或OH−得1分)
19. (1)0.2 mol(1分)(2)SO2、NO2(1分) (3)AC(全对给2分,答不全得1分)
20. (1)H2(1分)(2)①Fe+2H+=Fe2++H2↑②AlO2-+4H+=Al3++2H2O
③4Fe2++8NH3?H2O+O2+2H2O=4Fe(OH)3↓+8NH4+或:Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+、 4Fe(OH)2+O2+2H2O=4Fe(OH)3(每个2分)
(3) Al3+和Na+(全对给2分,答不全得1分) (4) H2SO4、HNO3(全对给2分,不全得1分)
21. (1)ECDBAGF(2分);酚酞(1分);无色变为浅红色(或粉红色)且半分钟不褪去(2分);
(2)偏大(1分)(3)100.00mL容量瓶(1分)(4)偏小 偏小 偏大(每个1分)
(5)4.20mol/L(2分)
22. (1) 7g;8g;(2) 3.5mol/L
B卷
B卷:23.C 24.D 25.C 26.B 27.B 28.C 29.D 30.C
31.(1)3.6 mol (2)≥0(说明:答“任意值”可得分)(3)3.6 mol< n(SO3)≤4 mol(每个2分)
32. (1)NH4C1、① ;(2)NH4Cl和NH3?H2O(答NH4Cl和NH3也给分);NH4Cl和HCl;
(3)小于 大于;(每个1分)
33. (1)将Fe3+ 还原为Fe2+;析出(或分离、或得到)FeSO4?7H2O;(每个2分)
(2) FeSO4?7H2O 石灰(或碳酸钙、废碱);(每个1分)
 (3)TiO2+2C+2Cl2 TiCl4+2CO(2分);CO(1分);①TiCl4+2Mg△ㄔㄔTi+2MgCl2(2分);②防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用(2分)③加入足量盐酸,除去金属镁,过滤,并用蒸馏水洗涤固体得金属钛。(2分)
(3)TiO2+2C+2Cl2 TiCl4+2CO(2分);CO(1分);①TiCl4+2Mg△ㄔㄔTi+2MgCl2(2分);②防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用(2分)③加入足量盐酸,除去金属镁,过滤,并用蒸馏水洗涤固体得金属钛。(2分)
34. (1)0.6 mol/L (2分);(2)97.5mL(2分);(3)35mL(3分)
铁是最常见的金属之一,铁可以形成多种氧化物、氢氧化物和盐类。铁与二氧化碳、水在某一密闭体系中反应情况如下表所示:
|
化学反应 |
平衡 常数 |
温度 |
|
|
973K |
1173K |
||
|
①Fe(s)+CO2(g) |
K1 |
1.47 |
2.15 |
|
②Fe(s)+H2O(g) |
K2 |
2.38 |
1.67 |
|
③CO(g)+ H2O(g)
|
K3 |
? |
? |
完成下列填空:
(1)反应①是 (选填“吸热”,“放热”)反应。根据反应①与②可以推导出同温下K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(2)973K时,若反应③在一个容积为2L的反应容器内2min时达到平衡,有3mol电子发生转移,则在2min内v(CO2)= 。若压缩容器的容积为原来的一半,平衡将 移动(选填“向左”,“向右”,“不”),CO2的浓度将 (选填“增大”,“减小”,“不变”)。使该反应的平衡转化率及平衡常数都增大的措施有 。
(3)在FeCl3稀溶液中滴加KSCN溶液后呈红色,反应的离子方程式是 ;若在其中加入少量KCl固体,溶液的颜色________(选填“变深”,“变浅”,“不变”)。
(4)若先往FeCl3溶液中加入足量NaF溶液,再滴加KSCN溶液,则不呈红色,若再加入足够量FeCl3溶液.又会呈现红色。请对上述实验现象作出解释 。
查看习题详情和答案>>
铁是最常见的金属之一,铁可以形成多种氧化物、氢氧化物和盐类。铁与二氧化碳、水在某一密闭体系中反应情况如下表所示:
| 化学反应 | 平衡 常数 | 温度 | |
| 973K | 1173K | ||
①Fe(s)+CO2(g) 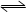 FeO(s)+CO(g) FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) 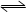 FeO(s)+H2(g) FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
③CO(g)+ H2O(g) 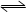 CO2(g)+ H2(g) CO2(g)+ H2(g) | K3 | ? | ? |
(1)反应①是 (选填“吸热”,“放热”)反应。根据反应①与②可以推导出同温下K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(2)973K时,若反应③在一个容积为2L的反应容器内2min时达到平衡,有3mol电子发生转移,则在2min内v(CO2)= 。若压缩容器的容积为原来的一半,平衡将 移动(选填“向左”,“向右”,“不”),CO2的浓度将 (选填“增大”,“减小”,“不变”)。使该反应的平衡转化率及平衡常数都增大的措施有 。
(3)在FeCl3稀溶液中滴加KSCN溶液后呈红色,反应的离子方程式是 ;若在其中加入少量KCl固体,溶液的颜色________(选填“变深”,“变浅”,“不变”)。
(4)若先往FeCl3溶液中加入足量NaF溶液,再滴加KSCN溶液,则不呈红色,若再加入足够量FeCl3溶液.又会呈现红色。请对上述实验现象作出解释 。 查看习题详情和答案>>
| 化学反应 | 平衡 常数 | 温度 | |
| 973K | 1173K | ||
①Fe(s)+CO2(g) 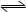 FeO(s)+CO(g) FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) 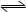 FeO(s)+H2(g) FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
③CO(g)+ H2O(g) 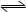 CO2(g)+ H2(g) CO2(g)+ H2(g) | K3 | ? | ? |
(1)反应①是 (选填“吸热”,“放热”)反应。根据反应①与②可以推导出同温下K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(2)973K时,若反应③在一个容积为2L的反应容器内2min时达到平衡,有3mol电子发生转移,则在2min内v(CO2)= 。若压缩容器的容积为原来的一半,平衡将 移动(选填“向左”,“向右”,“不”),CO2的浓度将 (选填“增大”,“减小”,“不变”)。使该反应的平衡转化率及平衡常数都增大的措施有 。
(3)在FeCl3稀溶液中滴加KSCN溶液后呈红色,反应的离子方程式是 ;若在其中加入少量KCl固体,溶液的颜色________(选填“变深”,“变浅”,“不变”)。
(4)若先往FeCl3溶液中加入足量NaF溶液,再滴加KSCN溶液,则不呈红色,若再加入足够量FeCl3溶液.又会呈现红色。请对上述实验现象作出解释 。
为证明化学反应有一定的限度,进行如下探究活动:
I.取5mL 0.1mol/L的KI溶液,滴加5—6滴FeCl3稀溶液;
Ⅱ.继续加入2mL CCl4,盖好玻璃塞,振荡静置。
Ⅲ.取少量分液后得到的上层清液,滴加KSCN溶液。
Ⅳ.移取25.00mLFeCl3稀溶液至锥形瓶中,加入KSCN溶液用作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点。重复滴定三次,平均耗用c mol/LKI标准溶液VmL。
(1)探究活动I中发生反应的离子方程式为 。
请将探究活动Ⅱ中“振荡静置”后得到下层液体的操作补充完整:将分液漏斗放在铁架台上,静置。
。
(2)探究活动Ⅲ的意图是通过生成红色的溶液(假设溶质全部为Fe(SCN)3),验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+ 猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察。
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,密度为0.71g/mL,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4—反应生成暗蓝色沉淀,用K4[Fe(CN)6](亚铁氰化钾)溶液检验Fe3+的灵敏度比用KSCN溶液更高。
结合新信息,现设计以下实验方案验证猜想:
①请完成下表
|
实验操作 |
现象和结论 |
|
步骤一: |
若产生暗蓝色沉淀,则 。 |
|
步骤二: |
若乙醚层呈红色,则 。 |
②写出实验操作“步骤一”中的反应离子方程式: 。
(3)根据探究活动Ⅳ,FeCl3稀溶液物质的量浓度为 mol/L。
查看习题详情和答案>>
为证明化学反应有一定的限度,进行如下探究活动:
I.取5mL 0.1mol/L的KI溶液,滴加5—6滴FeCl3稀溶液;
Ⅱ.继续加入2mL CCl4,盖好玻璃塞,振荡静置。
Ⅲ.取少量分液后得到的上层清液,滴加KSCN溶液。
Ⅳ.移取25.00mLFeCl3稀溶液至锥形瓶中,加入KSCN溶液用作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点。重复滴定三次,平均耗用c mol/LKI标准溶液VmL。
(1)探究活动I中发生反应的离子方程式为 。
请将探究活动Ⅱ中“振荡静置”后得到下层液体的操作补充完整:将分液漏斗放在铁架台上,静置。
。
(2)探究活动Ⅲ的意图是通过生成红色的溶液(假设溶质全部为Fe(SCN)3),验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+ 猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察。
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,密度为0.71g/mL,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4—反应生成暗蓝色沉淀,用K4[Fe(CN)6](亚铁氰化钾)溶液检验Fe3+的灵敏度比用KSCN溶液更高。
结合新信息,现设计以下实验方案验证猜想:
①请完成下表
| 实验操作 | 现象和结论 |
| 步骤一: | 若产生暗蓝色沉淀,则 。 |
| 步骤二: | 若乙醚层呈红色,则 。 |
②写出实验操作“步骤一”中的反应离子方程式: 。
(3)根据探究活动Ⅳ,FeCl3稀溶液物质的量浓度为 mol/L。 查看习题详情和答案>>
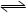 FeO(s)+CO(g)
FeO(s)+CO(g)