摘要:(3)NH4++H2ONH3?H2O+H+ H2O OH-+H+ c(NO3-)>c(NH4+)>c(H+)>c(OH-)(4)氧化钙溶于水放出大量热.温度升高.使氨的溶解度减小而放出,氧化钙吸水.促使氨放出,生成的氢氧化钙电离出的OH-增大了氨水中OH-浓度.促使氨水电离平衡左移.导致氨气放出.(5)abd
网址:http://m.1010jiajiao.com/timu_id_316691[举报]
 (2010?丰台区一模)[化学与技术]工业上可以利用氟硅酸、碳酸氢铵制备冰晶石(Na3AlF6),其工艺如下:
(2010?丰台区一模)[化学与技术]工业上可以利用氟硅酸、碳酸氢铵制备冰晶石(Na3AlF6),其工艺如下:
请回答下列问题:
(1)反应①中生成的无色气体A是
CO2
CO2
,滤液①的溶质是NH4F
NH4F
.(2)经测定NH4HCO3溶液呈中性,请分析原因(用离子方程式和文字表述说明理由)
NH4++H2O NH3?H2O+H+、HCO3-+H2O
NH3?H2O+H+、HCO3-+H2O H2CO3+OH-
H2CO3+OH-
NH4+和HCO3-的水解程度基本相同
 NH3?H2O+H+、HCO3-+H2O
NH3?H2O+H+、HCO3-+H2O H2CO3+OH-
H2CO3+OH-NH4+和HCO3-的水解程度基本相同
NH4++H2O NH3?H2O+H+、HCO3-+H2O
NH3?H2O+H+、HCO3-+H2O H2CO3+OH-
H2CO3+OH-
NH4+和HCO3-的水解程度基本相同
. NH3?H2O+H+、HCO3-+H2O
NH3?H2O+H+、HCO3-+H2O H2CO3+OH-
H2CO3+OH-NH4+和HCO3-的水解程度基本相同
(3)经反应②后,过滤得到的冰晶(Na3AlF6)固体,该固体上附着有杂质,需要洗涤,请简述如何证明冰晶石固体已经洗涤干净
取洗涤后的溶液,向其中滴加BaCl2溶液,无现象,说明已经洗涤干净;若有白色沉淀生成,说明没有洗涤干净
取洗涤后的溶液,向其中滴加BaCl2溶液,无现象,说明已经洗涤干净;若有白色沉淀生成,说明没有洗涤干净
.(4)温度和NH4HCO3浓度会影响反应①的速率.现设计如下实验方案探究温度和NH4HCO3浓
度对反应①速率的影响.请在表格空白处填写适当的反应条件.
| 实验编号 | 实验目的 | 温度 | c(NH4HCO3) |
| I | 为以下实验作参照 | 60℃ | c1 |
| II | 探究浓度对反应①速率的影响 | c2 | |
| III | 探究温度对反应①速率的影响 | 80℃ |
请分析t2℃时,滤液①中溶质的质量分数下降的原因是
温度升高NH4F会分解
温度升高NH4F会分解
. 下表中列出五种短周期元素A、B、C、D、E的信息,请推断后作答:
下表中列出五种短周期元素A、B、C、D、E的信息,请推断后作答:| 元素 | 有关信息 |
| A | 元素主要化合价为-2,原子半径为0.074n m |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子半径为0.102n m,其单质在A的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物的水化物,能按1:1电离出电子数相等的阴、阳离子 |
| E | 原子半径为0.075n m,最高价氧化物的水化物与其氢化物组成一种盐X |




(2)盐X水溶液显
酸
酸
(填“酸”“碱”“中”)性,用离子方程式解释其原因NH4++H2O NH3?H2O+H+
NH3?H2O+H+
 NH3?H2O+H+
NH3?H2O+H+NH4++H2O NH3?H2O+H+
NH3?H2O+H+
. NH3?H2O+H+
NH3?H2O+H+(3)D2CA3的溶液与B的单质能发生反应,其反应的离子方程式为
SO32-+Cl2+H2O=SO42-+2H++2Cl-
SO32-+Cl2+H2O=SO42-+2H++2Cl-
.(4)已知E元素的某种氢化物Y与A2的摩尔质量相同.Y与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液.该燃料电池放电时,正极的电极反应式是
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.(5)如图是一个电解过程示意图.假设使用Y-空气燃料电池作为本过程的电源,铜片质量变化128g,则Y一空气燃料电池理论上消耗标准状况下的空气(设空气中氧气的体积含量为20%)
112
112
L.(2012?昆明模拟)火力发电厂释放出的大量氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃烧废气进行脱硝、脱碳和脱硫等处理,可实验绿色环保、节能减排、废物利用.
(1)脱硝:利用甲烷催化还原NOx;
CH4(g)+4NO2(g)=CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为
(2)脱碳:将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)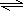 CH3OH(g)+H2O(g)△H<0
CH3OH(g)+H2O(g)△H<0
T℃时,取2mol CO2和4mol H2混合,加入到1L恒容密闭容器中,发生上述反应,10分钟后达到平衡时测得甲醇的体积分数为25%,计算氢气的转化率
(3)脱硫:某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物.设烟气中SO2、NO2的物质的量为1:1,写出该反应的化学方程式(不要求配平)
查看习题详情和答案>>
(1)脱硝:利用甲烷催化还原NOx;
CH4(g)+4NO2(g)=CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol
.(2)脱碳:将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)
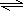 CH3OH(g)+H2O(g)△H<0
CH3OH(g)+H2O(g)△H<0T℃时,取2mol CO2和4mol H2混合,加入到1L恒容密闭容器中,发生上述反应,10分钟后达到平衡时测得甲醇的体积分数为25%,计算氢气的转化率
75%
75%
.T℃时该反应的化学平衡常数K=1
1
;升高温度,K减小
减小
.(选填“增大”“减小”“不变”)(3)脱硫:某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物.设烟气中SO2、NO2的物质的量为1:1,写出该反应的化学方程式(不要求配平)
NH3+O2+SO2+NO2+H2O→(NH4)2SO4+NH4NO3
NH3+O2+SO2+NO2+H2O→(NH4)2SO4+NH4NO3
.将生成的硫酸铵和硝酸铵的混合物溶解于水,室温下测得溶液的pH小于7,其原因是NH4++H2O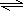 NH3?H2O+H+
NH3?H2O+H+
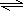 NH3?H2O+H+
NH3?H2O+H+NH4++H2O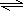 NH3?H2O+H+
NH3?H2O+H+
. NH3?H2O+H+
NH3?H2O+H+ (2007?淄博三模)铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸.某化学研究小组在实验室中按下列步骤模拟该生产过程.填写下列空白:
(2007?淄博三模)铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸.某化学研究小组在实验室中按下列步骤模拟该生产过程.填写下列空白:(1)配制实验用的溶液.要配制200mL密度为1.2g?cm-3的溶质质量分数为16%的NaOH溶液,需要称取
38.4
38.4
g NaOH固体.(2)把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗.写出除去氧化膜的离子方程式
Al2O3+2OH-+3H2O=2[A1(OH)4]-或Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-+3H2O=2[A1(OH)4]-或Al2O3+2OH-=2AlO2-+H2O
.(3)如图,组装好仪器,接通开关K,通电约25min.在阳极生成氧化铝,阴极产生气体.写出该过程中的电极反应式:
阳极
2Al+3H2O→Al2O3+6H++6e-
2Al+3H2O→Al2O3+6H++6e-
阴极
6H++6e-→3H2↑
6H++6e-→3H2↑
(4)断开电路,取出铝片,用1%稀氨水中和表面的酸液,再用水冲洗干净.写出该过程发生反应的离子方程式
NH3?H2O+H+=NH4++H2O
NH3?H2O+H+=NH4++H2O
.2007年8月《地球学报》杂志报道,利用氮、氧及氮、硼同位素技术,通过测定可知地下硝酸盐来源的水污染情况.
完成下列填空:
(1)关于14N与15N的正确说法是
a、自然界氮元素中14N的含量:空气中大于地壳中 b、单质:14N2与15N2互为同位素
c、电子层结构:14N与15N完全相同 d、原子半径:14N小于15N
与N元素同周期且最外层有2个未成对电子的元素相互组成的化合物属于
(2)NH3与H2O分别能与H+结合成NH4+与H3O+.与NH4+具有相同空间构型的微粒是
a、H3O+ b、CH4 c、P4 d、NH3
分子中的键角:CH4
(3)H3O+与NH4+的水溶液均显酸性.用离子方程式表示NH4+水溶液显酸性的原因:
(4)使用N、O、B同位素,并结合水化学分析,将更有利于对测定结果的解释.写出B原子的最外层电子排布式
查看习题详情和答案>>
完成下列填空:
(1)关于14N与15N的正确说法是
c
c
;a、自然界氮元素中14N的含量:空气中大于地壳中 b、单质:14N2与15N2互为同位素
c、电子层结构:14N与15N完全相同 d、原子半径:14N小于15N
与N元素同周期且最外层有2个未成对电子的元素相互组成的化合物属于
极性或非极性
极性或非极性
分子.(填:“极性”、“非极性”、“极性或非极性”)(2)NH3与H2O分别能与H+结合成NH4+与H3O+.与NH4+具有相同空间构型的微粒是
b、c
b、c
;a、H3O+ b、CH4 c、P4 d、NH3
分子中的键角:CH4
>
>
P4(填:“>”、“=”或“<”).(3)H3O+与NH4+的水溶液均显酸性.用离子方程式表示NH4+水溶液显酸性的原因:
NH4++H2O NH3?H2O+H+
NH3?H2O+H+
 NH3?H2O+H+
NH3?H2O+H+NH4++H2O NH3?H2O+H+
NH3?H2O+H+
. NH3?H2O+H+
NH3?H2O+H+(4)使用N、O、B同位素,并结合水化学分析,将更有利于对测定结果的解释.写出B原子的最外层电子排布式
2s22p1
2s22p1
;B原子核外的电子处在3
3
个不同的能级上.