网址:http://m.1010jiajiao.com/timu_id_287662[举报]
【查阅资料】铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑( 产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应.
【猜想】猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有
猜想3:该合金粉末中除铝外,还含有铁、铜.
【实验探究】下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液.
| 实验方案 | 实现现象 | 结论 |
| 1取一定量的合金粉末,加过量的 |
粉末部分溶解,并有气体放出. | 合金中一定含有 |
| ②取步骤①所得滤渣,加过量的 |
滤渣部分溶解,并有气体放出,溶液呈浅绿色. | 合金中一定含有 |
【反思】一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的
性质.写出铝与稀盐酸反应的化学方程式
【知识延伸】铜和铁是生产、生活中广泛使用的金属.
(1)工业上用一氧化碳和赤铁矿(主要成分是氧化铁)冶炼铁,反应的化学方程式为
(2)铜表面也容易生成绿色铜锈,铜锈的主要成分是碱式碳酸铜,化学式为Cu2(OH)2CO3,其组成元素有
(16分)为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案。请回答每个方案中提出的问题。
【方案I】
(1)称取碳酸钙样品 M g;
(2)加入过量盐酸;
(3)收集并测定生成的气体体积 V mL。
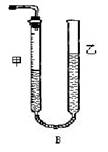
问题1:反应结束后,量气管中的显示如右图所示,接下来的操作是: ,读出甲管中液面的读数。
【方案II】
(1)称取碳酸钙样品 M g;
(2)用c mol/L 盐酸 V mL(过量)溶解样品;
(3)取溶解后的溶液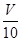 mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
问题2:列出本实验中所用到的主要仪器名称(除铁架台及附件、烧杯之外) 。
问题3:碳酸钙纯度计算公式 。
问题4:当碳酸钙溶解完全后,少量未溶的SiO2没过滤去,结果得到碳酸钙纯度________ (偏大、偏小或无影响)
【方案Ⅲ】
(1)称取碳酸钙样品 M g;
(2)加入足量c mol/L盐酸V mL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量c′ mol/L Na2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g。
问题5:此方案中不需要的数据是 (填选项编号)。
A.c、V B.c′、 V′ C. M′ D. M
问题6:为减少实验误差,步骤(3)、(5)过滤后都要对沉淀进行洗涤,如果步骤(3)未经洗涤,则测定的碳酸钙的纯度将 (偏大、偏小、无影响,下同);如果步骤(5)未经洗涤,则测定的碳酸钙纯度将 。
问题7:判断步骤(4)中Na2CO3溶液是否过量的方法是 。
查看习题详情和答案>>
华素片(西地碘片)使用说明 【品名和组成】 品名:西地碘片 商品名:华素片 英文名:Gydiodine tablets 含量:1.5 mg/片 将碘利用分子分散技术制成分子态西地碘,并含适量薄荷脑等。 【贮藏】 遮光、密闭、在阴凉处保存 【有效期】 二年 |
(1)根据上述说明和所学化学知识完成:
①华素片中活性成分是__________________ (写分子式)。
②请推断华素片__________________(“是”或者“不是”)白色的。
(2)某学生为验证华素片中确实含有上述成分,完成实验如下。请填空:
①取一粒药片放入研钵中研碎,再将药粉装入试管并加入约2 mL蒸馏水;向试管中加入约0.5 mL__________(填字母选项),并用力振荡。
A.酒精 B.热裂汽油 C.四氯化碳 D.甘油
②描述加入该液体后可能观察到的实验现象_______________________________________。
(3)请再设计另一种方法,验证华素片的成分(注意叙述实验操作方法和实验结论)。__________
____________________________________________________________________
_____________________________________________________________________。
查看习题详情和答案>>(16分)为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案。请回答每个方案中提出的问题。
【方案I】
(1)称取碳酸钙样品 M g;
(2)加入过量盐酸;
(3)收集并测定生成的气体体积 V mL。
问题1:反应结束后,量气管中的显示如右图所示,接下来的操作是: ,读出甲管中液面的读数。
【方案II】
(1)称取碳酸钙样品 M g;
(2)用c mol/L 盐酸 V mL(过量)溶解样品;
(3)取溶解后的溶液![]() mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
问题2:列出本实验中所用到的主要仪器名称(除铁架台及附件、烧杯之外) 。
问题3:碳酸钙纯度计算公式 。
问题4:当碳酸钙溶解完全后,少量未溶的SiO2没过滤去,结果得到碳酸钙纯度________ (偏大、偏小或无影响)
【方案Ⅲ】
(1)称取碳酸钙样品 M g;
(2)加入足量c mol/L盐酸VmL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量c′ mol/L Na2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g。
问题5:此方案中不需要的数据是 (填选项编号)。
A.c、V B.c′、V′ C. M′ D. M
问题6:为减少实验误差,步骤(3)、(5)过滤后都要对沉淀进行洗涤,如果步骤(3)未经洗涤,则测定的碳酸钙的纯度将 (偏大、偏小、无影响,下同);如果步骤(5)未经洗涤,则测定的碳酸钙纯度将 。
问题7:判断步骤(4)中Na2CO3溶液是否过量的方法是 。
查看习题详情和答案>>
在一次实验中,某同学把铝片分别放入稀盐酸、稀硫酸中,发现铝片与稀盐酸反应的现象非常明显,而与稀硫酸几乎不反应。这和课本中“铝能跟稀盐酸或稀硫酸反应生成氢气”的说法不一致。为了排除因试剂变质等因素造成的影响,该同学在老师的指导下重新进行了下列实验,验证是否存在上述现象。
【药品】3.0mol?L-1盐酸、1.5mol?L-1硫酸、3.0mol?L-1硫酸、相同大小的铝片(纯度>99.5%)
【实验过程】往三支相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol?L-1盐酸、1.5mol?L-1硫酸、3.0mol?L-1硫酸。观察反应进行到1、2、5、15、20min时铝与酸反应的情况。其结果如下:
通过上述实验可知,无论是用1.5mol?L-1H2SO4还是3.0mol?L-1H2SO4均无明显现象,
而3.0mol?L-1盐酸与铝片反应的现象却十分明显。
【提出问题】
(1)写出铝与酸反应的离子方程式:_____。
(2)反应1~15min内,铝与盐酸反应的反应速率逐渐加快,其原因是___________________。
(3)根据以上探究,你能对“铝与稀盐酸和稀硫酸反应差异的原因”作出哪些假设或猜想(列出两种即可)?
①___________________。
②___________________。
(4)为了验证上述假设,你设计的实验方案是___________________。