摘要:若要得到等量的Al(OH)3.则 A.三者消耗原料相同B.甲消耗原料最多C.乙消耗原料最少D.丙消耗原料最多
网址:http://m.1010jiajiao.com/timu_id_286615[举报]
B.聚合氯化铝(PAC)可以看成是AlCl3水解成为Al(OH)3的中间产物,其化学通式为[Al2(OH)nCl6-n]m(m≤10,n=3~5).若式中,n接近于6或等于6,则可称为铝溶胶.聚合氯化铝是一种无机高分子混凝剂.某合作学习小组的同学在查阅文献资料后拟用不同的方法制备聚合氯化铝.
(1)甲组用凝胶-溶胶法,它们用结晶氢氧化铝、烧碱、CO2及盐酸为试剂生产,其中涉及的氢氧化铝与烧碱反应的化学方程式为: .
(2)乙组采用不足量酸溶法,原料主要是铝加工的下脚料铝屑、铝灰和铝渣等,反应原理为:2Al+(6-n)HCl+nH2O=Al2(OH)nCl6-n+3H2↑.该制备方法工艺简单、成本低,利用本身是放热反应,故不需要加热,可能缺点有: (列举一条).
(3)丙组拟用高岭土(Al2O3?2SiO2?2H2O)等为原料,经焙烧、盐酸浸取、聚合、熟化、蒸发、干燥等步骤得到固体PAC.其中液体PAC蒸发时,适宜在110℃左右,你认为适宜的加热方法是 .
(4)丁组同学对甲、乙、丙组同学制得的样品进行定性实验,请你补充下列实验报告
(5)戊组同学对丙组固体样品请质检部门用27Al-NMR测试,其中的分散质主要是:Al13O4(OH)24Cl7,属于优质产品.他们另取样品mg少许放在坩埚中充分加热并灼烧,最终得到的固体产物为: ,若得到固体ng,则制得的样品中铝的质量分数为 .
查看习题详情和答案>>
(1)甲组用凝胶-溶胶法,它们用结晶氢氧化铝、烧碱、CO2及盐酸为试剂生产,其中涉及的氢氧化铝与烧碱反应的化学方程式为:
(2)乙组采用不足量酸溶法,原料主要是铝加工的下脚料铝屑、铝灰和铝渣等,反应原理为:2Al+(6-n)HCl+nH2O=Al2(OH)nCl6-n+3H2↑.该制备方法工艺简单、成本低,利用本身是放热反应,故不需要加热,可能缺点有:
(3)丙组拟用高岭土(Al2O3?2SiO2?2H2O)等为原料,经焙烧、盐酸浸取、聚合、熟化、蒸发、干燥等步骤得到固体PAC.其中液体PAC蒸发时,适宜在110℃左右,你认为适宜的加热方法是
(4)丁组同学对甲、乙、丙组同学制得的样品进行定性实验,请你补充下列实验报告
| 实验序号 | 实验步骤 | 实验现象 | 结论 |
| ① | 用激光笔照射甲组制得的PAC溶液 | 光亮的通路 | |
| ② | 取乙组制得的样品少许加入铝试剂阿罗明拿 | 变成玫瑰红色 | |
| ③ | 取丙组样品少许,溶于适量的水制得的淡黄色透明液体中加入氟化铵 |
某化工厂以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2.
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:MnO2+FeS+H2SO4=MnSO4+Fe2(SO4)3+S+H2O
(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按如图甲的工业流程进行操作处理得溶液(IV),电解溶液(IV)即得MnO2和Zn.
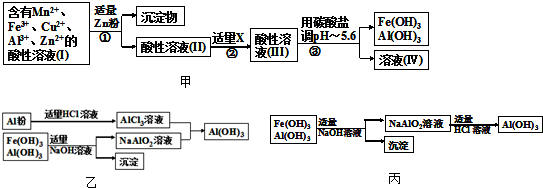
a、操作①中加Zn粉后发生反应的离子方程式为______.
b、操作②中加入适量X的作用是什么______;X的首选物的化学式是:______.
c、操作③中所加碳酸盐的化学式是______.
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如图乙的有关流程图.
a、AlCl3溶液和NaAlO2溶液反应生成AI(OH)3的离子方程式为______.若总共得到n molAl(OH)3,则消耗的NaOH和HCl的理论量(mol)分别为______、______.
b、若使用如图丙流程回收处理,请比较两个流程消耗酸碱的用量?______.
查看习题详情和答案>>
某化工厂以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2.
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:MnO2+FeS+H2SO4=MnSO4+Fe2(SO4)3+S+H2O
(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按如图甲的工业流程进行操作处理得溶液(IV),电解溶液(IV)即得MnO2和Zn.
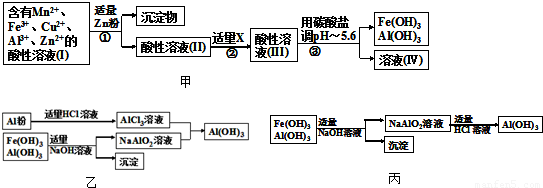
a、操作①中加Zn粉后发生反应的离子方程式为______.
b、操作②中加入适量X的作用是什么______;X的首选物的化学式是:______.
c、操作③中所加碳酸盐的化学式是______.
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如图乙的有关流程图.
a、AlCl3溶液和NaAlO2溶液反应生成AI(OH)3的离子方程式为______.若总共得到n molAl(OH)3,则消耗的NaOH和HCl的理论量(mol)分别为______、______.
b、若使用如图丙流程回收处理,请比较两个流程消耗酸碱的用量?______.
查看习题详情和答案>>
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:MnO2+FeS+H2SO4=MnSO4+Fe2(SO4)3+S+H2O
(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按如图甲的工业流程进行操作处理得溶液(IV),电解溶液(IV)即得MnO2和Zn.

a、操作①中加Zn粉后发生反应的离子方程式为______.
b、操作②中加入适量X的作用是什么______;X的首选物的化学式是:______.
c、操作③中所加碳酸盐的化学式是______.
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如图乙的有关流程图.
a、AlCl3溶液和NaAlO2溶液反应生成AI(OH)3的离子方程式为______.若总共得到n molAl(OH)3,则消耗的NaOH和HCl的理论量(mol)分别为______、______.
b、若使用如图丙流程回收处理,请比较两个流程消耗酸碱的用量?______.
查看习题详情和答案>>
绿色化学的要求之一就是原料的利用率尽可能高,现用稀硫酸、NaOH溶液和金属铝为原料制取
Al(OH)3,甲、乙、丙三个小组的同学的制备途径分别是:
若要得到等量的Al(OH)3,则 ()。
A.三者消耗的原料相等
B.甲消耗的原料最少
C.乙消耗的原料最少
D.丙消耗的原料最少
(2011?昌平区二模)铁元素及其化合物与人类的生产生活息息相关,回答下列问题
(1)铁酸钠(Na2FeO4)是一种新型水处理剂,它有比高锰酸钾更强的氧化性,在水中反应被还原为Fe3+.
①铁酸钠中铁元素的化合价为
②铁酸钠用于水处理,除了能消毒杀菌外,还可以像明矾(KAl(SO4)2)一样起到净水作用,请说明明矾的净水原理:
(2)反应ⅠFe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ?mol-1,平衡常数为K;
反应ⅡCO(g)+1/2O2(g)=CO2(g)△H=b kJ?mol-1测得在不同温度下,K值如下:
①写出反应Ⅰ的K的表达式
②反应Ⅰ中的a
③若500℃时进行反应Ⅰ,CO2起始浓度为2mol?L-1,CO的平衡浓度为
④700℃反应Ⅰ达到平衡,要使得该平衡向右移动,其它条件不变时,可以采取的措施有
A.缩小反应器体积 B.通入CO2
C.升高温度到900℃D.使用合适的催化剂
⑤由反应Ⅰ和Ⅱ可求得,反应2Fe(s)+O2(g)=2FeO(s)的△H=
(3)铁红是一种红色颜料,其成份是Fe2O3.将一定量的铁红溶于160mL 5mol?L-1盐酸中,再加入一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为
查看习题详情和答案>>
(1)铁酸钠(Na2FeO4)是一种新型水处理剂,它有比高锰酸钾更强的氧化性,在水中反应被还原为Fe3+.
①铁酸钠中铁元素的化合价为
+6
+6
.②铁酸钠用于水处理,除了能消毒杀菌外,还可以像明矾(KAl(SO4)2)一样起到净水作用,请说明明矾的净水原理:
Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
.(用离子方程式表示)(2)反应ⅠFe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ?mol-1,平衡常数为K;
反应ⅡCO(g)+1/2O2(g)=CO2(g)△H=b kJ?mol-1测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
k=
| c(CO) |
| c(CO2) |
k=
.| c(CO) |
| c(CO2) |
②反应Ⅰ中的a
大于
大于
0(填大于、小于、等于).③若500℃时进行反应Ⅰ,CO2起始浓度为2mol?L-1,CO的平衡浓度为
1
1
mol?L-1.④700℃反应Ⅰ达到平衡,要使得该平衡向右移动,其它条件不变时,可以采取的措施有
BC
BC
(填序号).A.缩小反应器体积 B.通入CO2
C.升高温度到900℃D.使用合适的催化剂
⑤由反应Ⅰ和Ⅱ可求得,反应2Fe(s)+O2(g)=2FeO(s)的△H=
2(a+b)
2(a+b)
kJ?mol-1.(3)铁红是一种红色颜料,其成份是Fe2O3.将一定量的铁红溶于160mL 5mol?L-1盐酸中,再加入一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为
11.2
11.2
g.