网址:http://m.1010jiajiao.com/timu_id_238048[举报]
一、(共69分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
B
C
A
D
D
C
D
C
B
B
A
B
题号
13
14
15
16
17
18
19
20
21
22
23
答案
C
B
C
A
C
A
B
A
B
D
C
二、(共15分)
24、A.Ⅰ⑴微量 儿童个头矮小、智力低下;甲状腺肿大、大脖子病等
⑵苯或四氯化碳等 ③⑥
⑶炒菜时不要先放盐或在烹饪快结束前再加入盐(每空1分,共5分)
Ⅱ⑷ C、H、O、N ⑸ C ⑹服用大量蛋清、牛奶或豆浆减缓毒性
⑺/扬州市2010届高考必修学业水平测试化学调研测试一.files/image038.jpg)
/扬州市2010届高考必修学业水平测试化学调研测试一.files/image040.jpg) (每空1分,共5分)
(每空1分,共5分)
Ⅲ⑻Na+ Cl- 水体富营养化(或水华、赤潮等)(3分)
⑼2CaCO3+O2+2SO2=2CaSO4+2CO2(2分)
B.Ⅰ(每空2分,共8分)(1) 乙酸乙酯 (2) CH3COOH
(3)醛基 (4) CH3COOH+CH3CH2OH/扬州市2010届高考必修学业水平测试化学调研测试一.files/image042.jpg) CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
/扬州市2010届高考必修学业水平测试化学调研测试一.files/image044.gif) Ⅱ(第(2)小题1分,其余每空2分。共7分)⑴ 氢氧化钠溶液
Ⅱ(第(2)小题1分,其余每空2分。共7分)⑴ 氢氧化钠溶液
/扬州市2010届高考必修学业水平测试化学调研测试一.files/image045.gif) ⑵ 蒸馏 ⑶ C2H5Br+NaOH
C2H5OH+NaBr
⑵ 蒸馏 ⑶ C2H5Br+NaOH
C2H5OH+NaBr
三、(共16分)
25、(每空1分)
⑴ 第 2 周期 ⅠA 族
⑵A+D→B+C的离子方程式为 2Na+2H2O=2Na++2OH―+H2↑
G+I→H的离子方程式为 2Fe2++Cl2= 2Fe3++2Cl―
⑶ 溶液变成血红色 ⑷_____Ⅰ>Ⅲ>Ⅱ__
26.(1)不一定,因为碳酸银,硫酸银都是沉淀(2分) (2)NH4+ 0.8mol/L (2分)
(3)BaCO3 BaSO4 (2分)CO32- 0.04mol 、SO42- 0.02mol(2分)
(4)A(2分)
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.(1)阴影部分元素N在元素周期表中的位置为第
根据元素周期律,预测:酸性强弱 H3AsO4
(2)元素S的最高正价和最低负价的代数和为
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是
(4)下列说法正确的是
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱.
(7分)
元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。
(1)阴影部分元素N在元素周期表中的位置为 周期 族 。 根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
(2)元素Se的最高正价和最低负价的代数和为____________; 在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”);
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是_____________。
(4)下列说法不正确的是 。
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
查看习题详情和答案>>
(8分)元素在周期表中的位置,反映了元素的原子结构和元素的性质,右图是元素周期表的一部分。
(1)阴影部分元素在元素周期表中的位置为第 族。根据元素周期律、预测;酸性强弱H2AsO4 H3PO4(用“>”或“<”表示)
(2)元素S的最高正价和最低负价的代数和为 ,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度)。请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是
(4)下列说法正确的是
A.C、N、O、F的原子半径随着原子数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
查看习题详情和答案>>
(8分)元素在周期表中的位置,反映了元素的原子结构和元素的性质,右图是元素周期表的一部分。
(1)阴影部分元素在元素周期表中的位置为第 族。根据元素周期律、预测;酸性强弱H2AsO4 H3PO4(用“>”或“<”表示)
(2)元素S的最高正价和最低负价的代数和为 ,在一定 条件下,S与H2反应有一定限度(可理解为反应进行的程度)。请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
条件下,S与H2反应有一定限度(可理解为反应进行的程度)。请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是
(4)下列说法正确的是
A.C、N、O、F的原子半径随着原子数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
(7分)
元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。
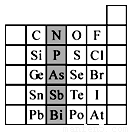
(1)阴影部分元素N在元素周期表中的位置为 周期 族 。 根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
(2)元素Se的最高正价和最低负价的代数和为____________; 在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”);
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是_____________。
(4)下列说法不正确的是 。
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
查看习题详情和答案>>