摘要:(3)据上述分析得:只有A不正确.</PGN0051.TXT/PGN>[投影]例8 在周期表主族元素中.甲元素与乙.丙.丁三元素上下或左右紧密相邻.甲.乙两元素的原子序数之和等于丙元素的原子序数.这四种元素原子的最外层电子数之和为20.据此可以判断:元素甲为 .元素丙为 .元素乙和丁所形成化合物的分子式为 或 .[组织讨论]请讨论解题思路并求解.读题.分析及解答:依据元素周期表中元素位―构―性三者之间的关系.利用题给信息.确定突破口:(1)可以最外层电子数之和为20猜想.甲的最外层电子数在5左右,(2)可以甲元素与乙.丙.丁三元素上下或左右紧密相邻.写出四种可能的位置关系.设出甲的序数.结合最外层电子数之和为20求解.答案:甲为N.丙为P.乙和丁的化合物为CO或CO2.[课堂小结] 精选题
网址:http://m.1010jiajiao.com/timu_id_234830[举报]
试管苗的光合作用能力较弱,需要逐步适应外界环境才能往大田移栽。研究人员进行了“改变植物组织培养条件缩短试管苗适应过程”的实验,实验在适宜温度下进行,图甲和图乙表示其中的两个实验结果。 请回答:
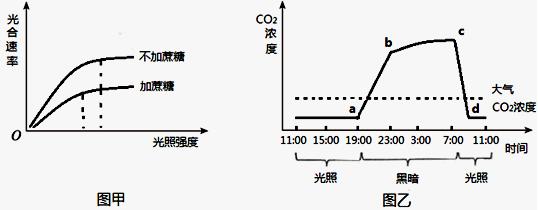
(1)图甲的实验是在大气CO2浓度下进行的。据图分析,试管苗在不加蔗糖的培养基中__________________更高。
(2)图乙是试管苗在密闭、无糖培养基条件下测得的24h内CO2浓度变化曲线。图中b-c段CO2浓度升高缓慢是因为________________________________________,c-d段CO2浓度急剧下降是因为试管苗________________________________________。若d点时打开培养瓶,试管苗的光合速率____________。
(3)根据上述实验结果推知,采用无糖培养基、____________和___________可缩短试管苗的适应过程。
查看习题详情和答案>>今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生
②第二份加足量NaOH溶液加热后,收集到气体0.04mol
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
试回答下列问题
(1)由实验②可知溶液中含有的离子为
(2)由实验③可以判断中溶液中含有的离子为
(3)由上述实验信息判断下列说法中正确的是
A.K+一定存在 B.100mL溶液中含0.01mol CO32-
C.Cl-可能存在 D.Ba2+一定不存在,Mg2+可能存在.
查看习题详情和答案>>
①第一份加入AgNO3溶液有沉淀产生
②第二份加足量NaOH溶液加热后,收集到气体0.04mol
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
试回答下列问题
(1)由实验②可知溶液中含有的离子为
NH4+
NH4+
,在100mL溶液中该离子的物质的量浓度为0.4mol/L
0.4mol/L
(2)由实验③可以判断中溶液中含有的离子为
CO32-,SO42-
CO32-,SO42-
(3)由上述实验信息判断下列说法中正确的是
AC
AC
A.K+一定存在 B.100mL溶液中含0.01mol CO32-
C.Cl-可能存在 D.Ba2+一定不存在,Mg2+可能存在.
 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示.
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示.(1)图中共有两条曲线X和Y,其中表示NO2浓度随时间变化的曲线是
X
X
;a、b、c、d四个点中,表示化学反应处于平衡状态的点是b、d
b、d
.(2)①前10min内用NO2表示的化学反应速率v(NO2)=
0.04
0.04
mol?L-1?min-1.②反应2NO2(g)?N2O4(g)在b点的平衡常数K(b)=
| 10 |
| 9 |
| 10 |
| 9 |
③反应2NO2(g)?N2O4(g)在d点的平衡常数K(d)与b点的平衡常数K(b)的关系:K(d)
=
=
K(b)(填“>”、“=”或“<”).(3)①据图分析,在25min时采取的措施是
C
C
(填序号).A.加入催化剂 B.缩小容器体积
C.加入一定量的NO2 D.加入一定量的N2O4
②若在35min时,保持温度不变,快速缩小容器的体积至1L,气体的颜色变化过程是
先变深后变浅,但比原平衡颜色深
先变深后变浅,但比原平衡颜色深
.①CaCO3═CaO(s)+CO2(g)△H=-177.7kJ/mol
②C(s)+H2O(g)═CO+H2△H=+131.3kJ/mol
③H2SO4(l)+2NaOH(l)═Na2SO4(l)+2H2O(l)△H=-114.6kJ/mol
④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
⑤CO(g)+
O2(g)═CO2(g)△H=-283kJ/mol
⑥HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H=-57.3kJ/mol
⑦2H2(g)+O2(g)═2H2O(l)△H=-517.6kJ
(1)上述热化学方程式中,不正确的有
(2)上述反应中,表示燃烧热的热化学方程式有
(3)实验测得,5g甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式
查看习题详情和答案>>
②C(s)+H2O(g)═CO+H2△H=+131.3kJ/mol
③H2SO4(l)+2NaOH(l)═Na2SO4(l)+2H2O(l)△H=-114.6kJ/mol
④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
⑤CO(g)+
| 1 | 2 |
⑥HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H=-57.3kJ/mol
⑦2H2(g)+O2(g)═2H2O(l)△H=-517.6kJ
(1)上述热化学方程式中,不正确的有
①②③⑦
①②③⑦
,不正确的理由分别是①△反应热△H=+177.7kJ/mol,②生成物的状态未标注,③除水的状态其余状态为“aq”,⑦反应热的单位为kJ/mol
①△反应热△H=+177.7kJ/mol,②生成物的状态未标注,③除水的状态其余状态为“aq”,⑦反应热的单位为kJ/mol
;(2)上述反应中,表示燃烧热的热化学方程式有
④⑤
④⑤
;表示中和热的热化学方程式有⑥
⑥
.(填热化学方程式的序号)(3)实验测得,5g甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式
2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol
2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol
.2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol是硫酸工业的关键反应.压强和温度对SO2转化率的影响如下表(原料气的体积分数为:SO27%,O211%,N282%).据表分析下列有关说法,其中正确的是( )
| 压强 MPa 转化率/% 温度℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
| A、温度一定时增大压强,SO2的转化率增大 |
| B、SO2转化为SO3,最好采用600℃的温度 |
| C、用催化剂不能增大SO2的转化率,但能增加反应放出的热量 |
| D、SO2尾气可用氨水吸收 |