网址:http://m.1010jiajiao.com/timu_id_233859[举报]
(10分)下列各种不同粒子16O、1H、28Si、3H、O2、18O、29Si、O3、2H、中:
(1)有_______种不同的核素;有_________种不同的元素
(2)互为同位素的是________________,________________,________________.
【解析】核素是指具有一定数目质子和中子的一种原子。元素是指具有相同核电荷数(即质子数)的一类原子。把具有相同质子数不同质量数的不同核素互称为同位素
查看习题详情和答案>>
(10分)下列各种不同粒子16O、1H、28Si、3H、O2、18O、29Si、O3、2H、中:
(1)有_______种不同的核素;有_________种不同的元素
(2)互为同位素的是________________,________________,________________.
【解析】核素是指具有一定数目质子和中子的一种原子。元素是指具有相同核电荷数(即质子数)的一类原子。把具有相同质子数不同质量数的不同核素互称为同位素
查看习题详情和答案>>
化合物A为一种常见金属元素与一种常见非金属元素组成的化合物,阳离子与阴离子的个数比为2:3。K为常见固态非金属单质,J、N为常见气态单质,其余为化合物,其中I、F在常温下为液态,C、D为刺激性气体,H无色无味气体,B为白色胶状沉淀,L为氯碱工业中的常见产品。F的浓溶液与K加热可生成D和H。(部分生成物未标出)

(1)H的结构式为: ;B的化学式为: 。
(2)写出下列变化的化学方程式:
A+I →B+C: 。
F的浓溶液与K加热可生成D和H: 。
(3)写出下列变化的离子方程式:
N通入E的水溶液: 。
M的水溶液中通人过量的H: 。
(4)在A~K所有物质中属于弱电解质的是_ ,属于非电解质的是 (用编号回答)。
查看习题详情和答案>>
晶体硅是信息科学和能源科学中的一种重要材料,可用于制芯片和太阳能电池等.以下是工业上制取纯硅的一种方法.
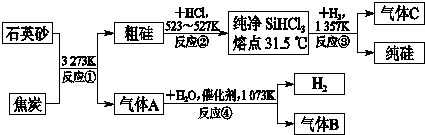
请回答下列问题(各元素用相应的元素符号表示):
(1)在上述生产过程中,属于置换反应的有
(2)利用反应③能制得纯硅的原因是
(3)化合物W的用途很广,通常可用作建筑工业和造纸工业的黏合剂,可作肥皂的填充剂,是天然水的软化剂.将石英砂和纯碱按一定比例混合加热至1373~1623K反应,生成化合物W,其化学方程式是
(4)A、B、C三种气体在生产过程中可循环使用的是
(5)工业上合成氨的原料H2是先将焦炭与水蒸气反应生成水煤气,再提纯水煤气得到纯净的H2,提纯水煤气得到纯净的H2的化学方程式为
(6)反应生成的气体只是A而不是B的原因是
已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素。其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍。D、E为同主族元素,且E的原子序数为D的2倍。F元素在地壳中含量位于金属元素的第二位。试回答下列问题:
(1)F元素价层电子排布式为 ____________________。
(2)关于B2A2的下列说法中正确的是 ________________。
A.B2A2中的所有原子都满足8电子结构
B.每个B2A2分子中σ键和π键数目比为1:1
C.B2A2是由极性键和非极性键形成的非极性分子
D.B2A2分子中的B-A键属于s—pσ键
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的空间构型是 ________________。
(4)C元素原子的第一电离能比B、D两元素原子的第一电离能高的主要原因____________
(5)A与D可以形成原子个数比分别为2:1,1:1的两种化合物X和Y,其中 Y含有_____________键(填“极性键”“非极性键”),A与C组成的两种化合物M和N所含的电子数分别与X、Y相 等,则M的电子式为_____________ ,N的结构式为______________。
(6)E的氢化物的价层电子对互斥理论模型为 _______,E 原子的杂化方式为 _________杂化。
(7)F单质的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。面心立方晶胞和体心立方晶胞的棱边长分别为acm、bcm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为____________,F原子配位数之比为_____________。
