摘要:1.B.C 2.C 3.C 4.C. 5.B
网址:http://m.1010jiajiao.com/timu_id_233614[举报]
B、C、D、E均是短周期元素,原子序数依次增大,B元素原子最外层上的电子数为内层电子总数的2倍.B元素原子和C元素原子最外层电子数之差为2.C和D形成的化合物进行焰色反应火焰呈黄色.E元素的气态单质、E的最高价氧化物的水化物均能与D的最高价氧化物的水化物反应.
(1)上述4种元素按照原子序数由大到小排列为______、______、______、______;(填元素符号);
(2)B、C形成的化合物(比空气重)的结构式为______;
(3)C、D的单质在加热条件下生成物质X,其中含有化学键的类型为______;X的电子式为______;
(4)E的离子结构示意图为______;
(5)Y是C的气态氢化物.常温下,将D的单质投入Y中,发生反应的离子方程式为______;该反应______(填“能”、“不能”)作为设计原电池的反应原理.
查看习题详情和答案>>
(1)上述4种元素按照原子序数由大到小排列为______、______、______、______;(填元素符号);
(2)B、C形成的化合物(比空气重)的结构式为______;
(3)C、D的单质在加热条件下生成物质X,其中含有化学键的类型为______;X的电子式为______;
(4)E的离子结构示意图为______;
(5)Y是C的气态氢化物.常温下,将D的单质投入Y中,发生反应的离子方程式为______;该反应______(填“能”、“不能”)作为设计原电池的反应原理.
Ⅰ.(5分)请选择合适方法的填空(用字母填):
A.过滤 B.裂解 C.分馏 D.裂化 E.干馏 F.还原 G.电解 H.蒸发
(1)从海水中提取粗盐________;
(2)重油转变为汽油________;
(3)石油炼制得到汽油、煤油、柴油等________;
(4)煤转化为焦炭、煤焦油等________________;
(5)工业上由氧化铝制取金属铝________;
Ⅱ(4分)从A、乙醇;B、乙酸;C、甲烷;D、苯四种种物质中选择合适的答案填在空格内(用字母填):
(1)分子具有正四面体结构的是_________;
(2)跟碳酸氢钠溶液反应有二氧化碳生成的是___________;
(3)能作为燃料使用,属于可再生能源的是____________:
(4)分子中所有原子均共面的是_________________________.。
查看习题详情和答案>>A、B、C、D、E、F、G全为短周期元素,它们在中学常见化合物中显示的部分化合价及原子、离子半径从大到小的序号如下:(注:半径按①、②、③…的顺序依次减小)
(1)用电子式表示BA2的形成过程
 .
.
(2)写出F的最高价氧化物对应的水化物和G的最高价氧化物对应的水化物反应的离子方程式
(3)请设计实验比较B、F的活动性强弱.
查看习题详情和答案>>
| 元素 性质 |
A | B | C | D | E | F | G |
| 化合价 | +1、+5、+7 | 只有+2 | +4 | -3、+2、+4、+5 | 只有-1 | 只有+3 | 只有+1 |
| 原子半径 | ⑤ | ② | ④ | ⑥ | ⑦ | ③ | ① |
| 离子半径 | ① | ⑤ | 无离子 | ② | ③ | ⑥ | ④ |


(2)写出F的最高价氧化物对应的水化物和G的最高价氧化物对应的水化物反应的离子方程式
Al(OH)3+OH-═AlO2-+2H2O.
Al(OH)3+OH-═AlO2-+2H2O.
.(3)请设计实验比较B、F的活动性强弱.
| 元素 | 实验设计 | 现象 | 结论 |
| B | 活动性:B F (填“>”、“<”或“=”) | ||
| F |
A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
(1)写出下列元素的符号:A
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
(4)D的氢化物比C的氢化物的沸点
(5)E元素原子的核电荷数是
(6)A、B、C最高价氧化物的晶体类型是分别是
(7)画出D的核外电子排布图
 ,这样排布遵循了
,这样排布遵循了
查看习题详情和答案>>
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:(1)写出下列元素的符号:A
Si
Si
BNa
Na
CP
P
DN
N
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
HNO3
HNO3
,碱性最强的是NaOH
NaOH
.(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
F
F
,电负性最大的元素是F
F
.(4)D的氢化物比C的氢化物的沸点
高
高
(填“高“或“低“),原因氨气分子之间含有氢键
氨气分子之间含有氢键
(5)E元素原子的核电荷数是
26
26
,E元素在周期表的第四
四
周期,第Ⅷ
Ⅷ
族,已知元素周期表可按电子排布分为s区、p区等,则E元素在d
d
区.(6)A、B、C最高价氧化物的晶体类型是分别是
原子
原子
晶体、离子
离子
晶体、分子
分子
晶体(7)画出D的核外电子排布图


泡利
泡利
原理和洪特
洪特
规则.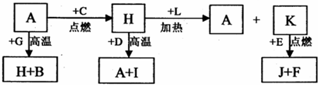 A、B、C、D、E、F 是常见单质,其中 A 是用量最大,应用最广泛的金属;元素 D 是地壳中含量最多的金属元素:D 元素和 E 元素在周期表中相邻,G、H、l、J、K、L 是常见化合物,其中 G 在常温下是无色液体,H 是黑色晶体,以上物质相互间的转化关系如图所示:
A、B、C、D、E、F 是常见单质,其中 A 是用量最大,应用最广泛的金属;元素 D 是地壳中含量最多的金属元素:D 元素和 E 元素在周期表中相邻,G、H、l、J、K、L 是常见化合物,其中 G 在常温下是无色液体,H 是黑色晶体,以上物质相互间的转化关系如图所示:请回答下列问题:
(1)元素 A 在元素周期表中的位置为
四
四
(周期)VIII
VIII
(族).(2)写出 K 的电子式
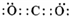
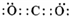
(3)写出 H 和 D 反应的化学方程式
3Fe3O4+8Al
4A12O3+9Fe
| ||
3Fe3O4+8Al
4A12O3+9Fe
.
| ||
(4)D 能与氢氧化钠溶液反应,请写出该反应的离子方程式:
3Fe3O4+8Al
4A12O3+9Fe;
| ||
3Fe3O4+8Al
4A12O3+9Fe;
.
| ||
(5)写出 A 与 G 反应的化学方程式
3Fe+4H2O ( g )
Fe3O4+4H2
| ||
3Fe+4H2O ( g )
Fe3O4+4H2
.
| ||
(6)K 与 E 反应时产生的现象有
镁带剧烈燃烧,(产生耀眼的白光,)瓶壁或瓶底出现白色固体和黑色颗粒
镁带剧烈燃烧,(产生耀眼的白光,)瓶壁或瓶底出现白色固体和黑色颗粒
,该反应的化学方程式为2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
.
| ||