网址:http://m.1010jiajiao.com/timu_id_209883[举报]
1―5ADCBD 6―10CBCCD 11―15CBCBD 16―20BDBDC
21.(6分)NH4I>NH4Br>NH4Cl>NH
接FCl Br I的顺序,半径增大,夺取质子的能力减弱。(3分)
22.(8分)(1)14HNO3+3Cu2O→6Cu(NO3)2+2NO↑+7H2O(2分)
(2)酸性 氧化性(各1分)
(3)0.6mol(2分)
(4)使用了较浓的硝酸,产物中有部分二氧化氮生成(2分)
23.(8分)(1)D Na+
(2)第三周期 第IIIA族
(3)钙(每空2分)
24.(8分)(1)H-O-H 4NA (每空2分)
(2)①H2O>NH3>H2S (每空2分)
②SO2+2H2S==2H2O+3S↓(末写↓不扣分)(2分)
(2)
正极反应:Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)(1分)
负极反应:Cu=2Cu2++2e-(或Cu-2e-=Cu2+)(1分)
(3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2―4.7;③过滤(除去Fe(OH)3)(各1分共3分)
(4)CuO+H2SO4=CuSO4+H2O(2分)
CuSO4+Fe=FeSO4+Cu(2分)
不锈钢表面有紫红色物质生成(2分)
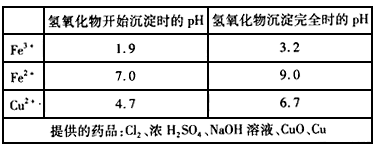
(1)FeCl3溶液常用于腐蚀印刷电路板,反应的离子方程式为________.
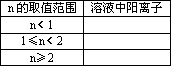
(2)向含有1 mol CuCl2、2 mol FeCl3的腐蚀铜板后的混合液中加入铁粉n mol,试分析溶液中阳离子的各种情况填入下表:
(3)腐蚀铜板后的混合液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:________.

铁及铁的化合物应用广泛,如FeCl3可用作印刷电路铜板腐蚀剂.
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式________.
腐蚀铜板后的混合溶液中,若Cu2+、Fe3+的浓度均为0.10 mol·L-1,不考虑溶液体积的变化,则原FeCl2溶液的浓度为________.
(2)某化学小组在实验室按照下列操作分离腐蚀铜板后的混合液并制取有关物质,图示如下:
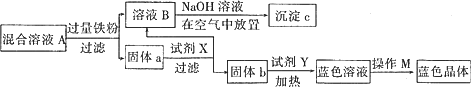
请回答下列问题:
①试剂X为________;试剂Y为________;操作M为________.
②固体c的化学式为________.
③检验混合溶液B中是否存Fe3+的操作是________.
(2)向含有1 mol CuCl2、2 mol FeCl3的腐蚀铜板后的混合液中加入铁粉n mol,试分析溶液中阳离子的各种情况填入下表

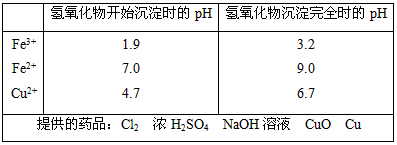

①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1mol?L-1,今向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为
②从图1中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2]=
(2)25℃时,测得浓度为0.1mol?L-1的HA溶液的pH=3,则HA的电离常数Ka=
(3)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如2图所示(实线).图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6mol.
①下列时间段平均反应速率最大的是
A.0-1min B.1-3min C.3-8min D.8-11min
②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图2中虚线所示,曲线Ⅰ对应的实验改变的条件是
③根据该反应特点,此反应自发进行的条件是
(4)铁是一种廉价的金属,除了做为重要的结构材料外,现又有了新的用途,磷酸聚合物铁锂电池以其廉价、高容量和安全性逐渐占据市场.高铁电池的研究也在进行中.下图是高铁电池的实验装置:
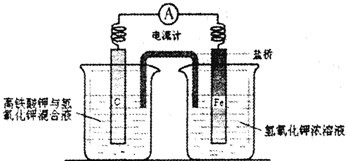
已知放电后,两极反应均生成Fe的+3价的化合物.
①该电池放电时正极发生的电极反应是
②若该电池属于二次电池,则充电时阴极反应的电极反应式为
