摘要:1.5 mol2 mol
网址:http://m.1010jiajiao.com/timu_id_204490[举报]
|
在CaF2(Ksp=5.3×10-9 mol3·L-3)与CaSO4(Ksp=9.1×10-6 mol2·L-2)混合的饱和溶液中,测得F-浓度为1.8×10-3 mol·L-1,则溶液中SO | |
A. |
3.0×10-3 mol·L-1 |
B. |
5.7×10-3 mol·L-1 |
C. |
1.6×10-3 mol·L-1 |
D. |
9.0×10-4 mol·L-1 |
25℃时水的KW=1.0×10-14 mol2?L-2,而100℃时水的KW=5.5×10-13 mol2?L-2.若在100℃时某溶液的[H+]=1.0×10-7 mol?L-1,则该溶液呈( )
| A、酸性 | B、中性 | C、碱性 | D、可能是酸性,也可能是碱性 |
已知BaSO4和CaSO4的溶度积分别为1.1×10-10 mol2·L-2和9.1×10-6 mol2·L-2.计算:
(1)将0.5 L 2.0×10-3 mol·L-1的BaCl2溶液与0.5 L 2.0×10-3 mol·L-1的Na2SO4溶液混合,________(填“有”或“没有”)沉淀生成,原因是________.如果有沉淀生成,则生成的沉淀的物质的量是________mol.
(2)现有0.010 mol CaSO4,要把它配成CaSO4饱和溶液,最多加多少体积水?
已知在BaCO3饱和溶液中[Ba2+]·[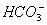 ]=8.1×10-9 mol2·L-2,
]=8.1×10-9 mol2·L-2,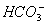
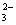 H++
H++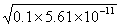 的电离平衡常数K=5.61×10-11。?
的电离平衡常数K=5.61×10-11。?
在0.2 mol·L-1的BaCl2溶液中加入等体积的0.2 mol·L-1的NaHCO3溶液。通过计算说明混合后的溶液中有无沉淀。??
查看习题详情和答案>>(14分)下表是不同温度下水的离子积数据:
| 温度/℃ | 25 | t1 | t2 |
| Kw/ mol2·L-2 | 1×10-14 | a | 1×10-12 |
(1)若25< t1< t2,则a 1×10-14(填“<”、“>”或“=”),由此判断的理由是:
(2)在25 ℃下,pH=10的NaOH溶液中,水电离产生的[OH-]为:
(3)若某温度下,纯水中c(H+) = 5×10-7 mol·L-1,则此时纯水中的c(OH-)=_______________;若温度不变,滴入稀硫酸使c(H+)=5.0×10-3 mol·L-1,则c(OH-)=_______________。 查看习题详情和答案>>