网址:http://m.1010jiajiao.com/timu_id_161464[举报]
下列各物质中所含原子个数由多到少的顺序正确的是
①0.5mol氨气; ②标准状况下22.4L氦气 ③4℃时9mL水; ④0.2mol磷酸
A. ④③②① B. ①④③② C. ②③④① D. ①④②③
二、选择题(本题包括10小题,每题3分,共30分,每小题有一个或两个选项符合题意)
查看习题详情和答案>>(1)D在元素周期表中的位置是
(2)C的最高价氧化物对应的水化物的化学式为
(3)A与B形成的化合物中,相对分子质量最小的化合物的电子式为
(4)E单质与水反应的离子方程式为
(5)实验室制取G单质的化学方程式为
(6)写出F的最高价氧化物在工业上的用途
二茂铁(结构如图)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到。反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O
二茂铁的熔点为172~173℃,在100℃开始升华。能溶于乙醚、二甲亚砜等非极性溶剂,不溶于水,对碱和非氧化性酸稳定。制备的步骤如下:
步骤1.在150mL的三颈瓶中加入25g细粉末状KOH和60mL无水乙醚,通入氮气并搅拌约10分钟使之尽可能溶解,然后加入5.5 mL环戊二烯,再搅拌10分钟。
步骤2. 向烧杯中加入25 mL二甲亚砜和6.5g新制的无水氯化亚铁,微热至40℃并搅拌使其溶解,然后加入滴液漏斗中。
步骤3. 按图所示的装置装配好仪器,打开滴液漏斗的活塞,缓慢将氯化亚铁等加入三颈瓶中,并继续搅拌1小时。
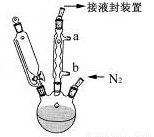
步骤4. 反应结束后,将混合物倒入100mL 18%的盐酸溶液,将烧杯放在冰浴中冷却,搅拌约10分钟,使结晶完全。
步骤5. 抽滤,将获得的产品以冷水洗涤2~3次,低温风干得到粗制的二茂铁。
(1)步骤1中通入N2的目的可能是 。
(2)步骤2中,滴液漏斗侧边的玻璃导管的作用是 。
(3)实验装置中,冷凝管通水,水应从 口进(选填a或b)。
(4)步骤4将反应后的混合物倒入盐酸中,发生主要反应的离子方程式是 。
(5)步骤5用冷水洗涤是因为 ,因此可采用 的方法,进一步提纯二茂铁。
查看习题详情和答案>>