摘要:5.要注意扩大学生的视野.能源.新材料.生命科学.医学.海洋资源.大气资源.生态环境等与生产.生活.科技密切联系的领域是进行复习和高考中的切入点.学生要善于将这些内容与我们中学所学过的有关知识联系起来进行分析.从而获得解决问题的方法和途径.通过这些内容的训练培养学生思维的逻辑性.发散性和全面性.
网址:http://m.1010jiajiao.com/timu_id_127439[举报]
(2011?平顶山二模)碳酸钠俗称纯碱、苏打,是一种常用的日用化学品.在实验室里,可用如图所示装置,以氯化钠、二氧化碳、氨等为原料制备纯碱.实验时,先检验装置的气密性,再向各仪器中加入试剂,打开启普发生器(装置A)活塞,产生二氧化碳气体,制备纯碱.请回答以下有关问题:
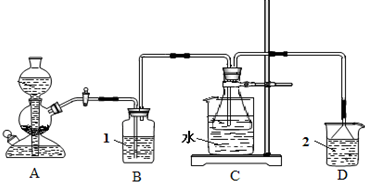
(1)碳酸氢钠受热分解的化学方程式为
(2)实验中,要注意控制二氧化碳的通入速度(以出现能数得清的连续气泡为好)和水浴的温度.实验中不能过快的通入二氧化碳的目的是
实验时,锥形瓶中产生了NH4HCO3、NaCl、NaHCO3和NH4Cl的混合液.右表是四种化合物在部分温度下的溶解度.由表中数据可知,反应时水浴的温度不能超过
(3)饱和食盐水,还可以通过电解过程制取烧碱.制备过程中,烧碱溶液主要在电解池的
查看习题详情和答案>>

(1)碳酸氢钠受热分解的化学方程式为
2NaHCO3
Na2CO3+H2O+CO2↑
| ||
2NaHCO3
Na2CO3+H2O+CO2↑
;实验时装置A中发生反应的化学方程式为
| ||
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
;C装置的锥形瓶中,装有含氨的饱和食盐水,则溶液1应为饱和碳酸氢钠溶液
饱和碳酸氢钠溶液
,溶液2应为稀硫酸
稀硫酸
.(2)实验中,要注意控制二氧化碳的通入速度(以出现能数得清的连续气泡为好)和水浴的温度.实验中不能过快的通入二氧化碳的目的是
增大二氧化碳的吸收率
增大二氧化碳的吸收率
.化学实验中水浴加热法的优点为利于控制反应体系的温度和使其受热均匀
利于控制反应体系的温度和使其受热均匀
.实验时,锥形瓶中产生了NH4HCO3、NaCl、NaHCO3和NH4Cl的混合液.右表是四种化合物在部分温度下的溶解度.由表中数据可知,反应时水浴的温度不能超过
40
40
℃.反应结束,将反应混合液冷却到15℃左右,析出的固体应主要含有NaHCO3
NaHCO3
(填化学式).| 温度 | 10℃ | 20℃ | 30℃ | 40℃ |
| 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
| 碳酸氢铵 | 15.8 | 21.0 | 27.0 | 分解 |
| 碳酸氢钠 | 8.1 | 9.6 | 11.1 | 12.7 |
| 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 |
阴
阴
极区产生,原因是该极区氢离子放电,产生出氢氧根离子
该极区氢离子放电,产生出氢氧根离子
.
类比思维是学习化学的重要方法,但结果是否正确必须经受检验.在进行类比思维的时候,不能机械类比,一定要注意一些物质的特殊性,以防止类比出错误的结论.凭已有的化学知识,下列类比结果正确的是:(填标序号) .若错误,在其后写出正确的.
①在相同条件下,Na2CO3溶解度比NaHCO3大
类比:在相同条件下,CaCO3溶解度比Ca(HCO3)2大
正确的应该为(若类比正确,此处不写,下同): .
②向次氯酸钙溶液中通过量CO2:CO2+ClO-+H2O═HCO3-+HClO
类比:向次氯酸钠溶液中通过量SO2:SO2+ClO-+H2O═HSO3-+HClO
正确的应该为: .
③根据化合价Fe3O4可表示为:FeO?Fe2O3
类比:Fe3I8也可表示为FeI2?2FeI3
正确的应该为: .
④CaC2能水解:CaC2+2H2O═Ca(OH)2+C2H2↑
类比:Al4C3也能水解:Al4C3+12H2O═4Al(OH)3↓+3CH4↑
正确的应该为: .
查看习题详情和答案>>
①在相同条件下,Na2CO3溶解度比NaHCO3大
类比:在相同条件下,CaCO3溶解度比Ca(HCO3)2大
正确的应该为(若类比正确,此处不写,下同):
②向次氯酸钙溶液中通过量CO2:CO2+ClO-+H2O═HCO3-+HClO
类比:向次氯酸钠溶液中通过量SO2:SO2+ClO-+H2O═HSO3-+HClO
正确的应该为:
③根据化合价Fe3O4可表示为:FeO?Fe2O3
类比:Fe3I8也可表示为FeI2?2FeI3
正确的应该为:
④CaC2能水解:CaC2+2H2O═Ca(OH)2+C2H2↑
类比:Al4C3也能水解:Al4C3+12H2O═4Al(OH)3↓+3CH4↑
正确的应该为: