网址:http://m.1010jiajiao.com/timu_id_116385[举报]
(10分)酸雨是指pH<5.6的雨、雪等各种形式的大气降水。二氧化硫是形成酸雨的主要因素之一,它主要是由含硫燃料(煤和石油)燃烧和金属冶炼厂释放的二氧化硫气体造成。酸雨的危害极大,减少二氧化硫等污染物的排放,保护环境是非常重要的。某校化学兴趣小组的学生,分成两组对酸雨及空气中二氧化硫的含量进行了测定。
第一组,取刚降到地面的酸雨水样,进行了如下实验:
(1)将一片红色的玫瑰花瓣浸在一份水样中
(2)向雨水试样中滴加氯化钡溶液,有白色浑浊出现
(3)每隔一定时间测定其pH,数据如表Ⅰ所示。
表Ⅰ 不同时间酸雨的pH
| 测定时间/小时钟 | 0 | 1 | 2 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
(1)一段时间后,观察到红色变浅,可能的原因是 ▲
(2)生成白色浑浊的离子方程式 ▲
(3)分析上述pH数据变化,你认为可能的原因是(用化学方程式表示) ▲
(4)如果取该雨水和蒸馏水混合,再测pH,结果将 ▲ (填“变大”“变小”或“不变”)
第二组,用拟用下列装置定量分析空气中SO2的含量:

(5)该组同学查资料得到的反应原理为:SO2与酸性KMnO4溶液反应的离子方程式
5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+。
该反应的现象是 ▲ ,SO2在该反应中显 ▲ (填“氧化”或“还原”)性。发生了 ▲ 反应(填“氧化”或“还原”)
(6)通入空气前应进行的实验操作是 ▲ ;KMnO4溶液中导管末端做成球状多孔结构的作用是 ▲
(7)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L。若从气体通入到紫色恰好褪去,用时5分钟。则此次取样处的空气中二氧化硫含量为 ▲ g/L
查看习题详情和答案>>研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
| 离子 | 离子半径(pm) | 开始沉淀 时的pH | 完全沉淀 时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |

请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的化学方程式 。
(2)氧化过程中主要反应的离子方程式 。
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是 ,应调节pH的范围为 。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有 、 等;吸附步骤除去的主要离子为: 。
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2 mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是 。 查看习题详情和答案>>

已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
| 离子 | 离子半径(pm) | 开始沉淀 时的pH | 完全沉淀 时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |

请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的化学方程式 。
(2)氧化过程中主要反应的离子方程式 。
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是 ,应调节pH的范围为 。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有 、 等;吸附步骤除去的主要离子为: 。
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2 mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是 。
工业上常利用低品位软锰矿浆(主要成分是MnO2)来吸收含SO2的废气,最终制得硫酸锰晶体(MnSO4·H2O),其主要流程如下:

已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时溶液的pH见下表:
|
离子 |
开始沉淀时的pH |
完全沉淀时的pH |
|
Fe2+ |
7.6 |
9.7 |
|
Fe3+ |
2.7 |
3.7 |
|
Al3+ |
3.8 |
4.7 |
|
Mn2+ |
8.3 |
9.8 |
(1)软锰矿浆中通入含SO2废气后,发生主要反应的化学方程式为____________________。
(2)浸出液中加入MnO2粉末的目的是____________;反应的离子方程式是___________________。
(3)溶液中加入石灰浆来调节pH,其作用是_________________;pH应调节的范围是__________。
(4)滤渣的主要成分是________________________________________________(用化学式表示)。
查看习题详情和答案>>
工业上常利用低品位软锰矿浆(主要成分是MnO2)来吸收含SO2的废气,最终制得硫酸锰晶体(MnSO4·H2O),其主要流程如下: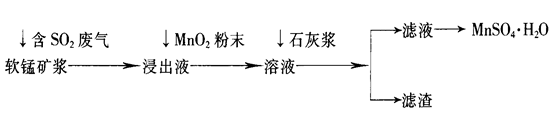
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时溶液的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
(1)软锰矿浆中通入含SO2废气后,发生主要反应的化学方程式为____________________。
(2)浸出液中加入MnO2粉末的目的是____________;反应的离子方程式是___________________。
(3)溶液中加入石灰浆来调节pH,其作用是_________________;pH应调节的范围是__________。
(4)滤渣的主要成分是________________________________________________(用化学式表示)。 查看习题详情和答案>>