摘要:[解析]NaCl溶液涉及的工业生产为侯氏制碱.G为NaHCO3.H为Na2CO3.I为NH4Cl.A是一种含两种元素组成的液态有机溶剂.A和B反应前后气体体积保持不变.A为CS2.B为氧气.反应CS2+3O2=CO2+2SO2反应前后气体体积不变.所以C为CO2.D为SO2.式量关系M(SO2)=2M(O2)=2M(s )符合题意.SO2的催化氧化是工业制硫酸的重要反应.M为硫酸.L为单质.反应生成蓝色溶液.L为铜.在加热条件下铜与硫反应生成硫化亚铜.反应⑤⑥互为可逆反应.且属于置换反应.K为水.O不可能为氧气只能为氢气.涉及可逆置换反应为3Fe+4H2O(g)Fe3O4+4H2.图为铜和硫酸反应制H2不能自发完成.故反应只有通过电解才可能完成.铜作阳极.硫酸为电解质溶液.[答案]⑴CS2⑵ NaCl+CO2+H2O+NH3 NaHCO3↓+NH4Cl 联合制碱法或侯氏制碱法
网址:http://m.1010jiajiao.com/timu_id_116349[举报]
 (2011?湖南二模)[化学一选修化学与技术]
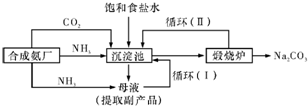
(2011?湖南二模)[化学一选修化学与技术]纯碱(Na2CO3)在工业生产和生活中有重要应用,其实验室制法和工业制法如下:
【实验室制备纯碱】
(1)将饱和NaCl溶液倒入烧杯中加热,控制温度为30?350C
(2)搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟
(3)静置、过滤得NaHCO3晶体
(4)用少量蒸馏水洗涤、抽干
(5)将所得固体转人蒸发皿中灼烧得Na2CO3固体
问题:①反应将温度需控制在30?35曟,通常采取的加热方法为
水浴加热
水浴加热
;控制该温度的原因是温度过高时碳酸氢铵受热分解剧烈,温度太低又减慢了化学反应的速率
温度过高时碳酸氢铵受热分解剧烈,温度太低又减慢了化学反应的速率
.②静置后只析出NaHCO3晶体的原因是
相同温度下,碳酸氢钠的溶解度小
相同温度下,碳酸氢钠的溶解度小
.【工业制备纯碱】
③沉淀池中反应的离子方程式为
NH3+CO2+H2O+Na++Cl-=NH4++Cl-+NaHCO3↓
NH3+CO2+H2O+Na++Cl-=NH4++Cl-+NaHCO3↓
;④循环(I)、循环(II)中物质的化学式分别为
NaCl、CO2
NaCl、CO2
.两种制备纯碱的方法中,共同涉及的化学反应方程式为NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓,
2NaHCO3
Na2CO3+H2O+CO2↑
2NaHCO3
| ||
NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓,
2NaHCO3
Na2CO3+H2O+CO2↑
.2NaHCO3
| ||