网址:http://m.1010jiajiao.com/timu_id_115122[举报]
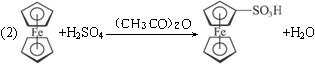
二茂铁是橙黄色针状晶体,熔点
二茂铁常见制备方法:
①合成法:由金属钠与环戊二烯(C5H6![]() )在四氢呋喃(
)在四氢呋喃(![]() 代号THF)溶液中反应,先制得环戊二烯钠,然后让环戊二烯钠与氯化亚铁反应制得二茂铁。
代号THF)溶液中反应,先制得环戊二烯钠,然后让环戊二烯钠与氯化亚铁反应制得二茂铁。
②电解法:电解时,以铁板和镍板作电极,电解液为碘化钠的环戊二烯溶液。
阅读以上材料,试回答下列问题:
(1)环戊二烯与二茂铁中各有___________种和___________种化学环境不同的氢原子。
(2)写出二茂铁与浓硫酸、醋酸酐〔(CH3CO)2O〕混合发生磺化反应生成一取代物的反应式:____________________________________________________________,并预测二茂铁能否发生硝化反应,说明理由_________________________________________________________。
(3)写出合成法制备二茂铁的相关化学方程式:_____________________________________。
(4)写出电解法制备二茂铁的阳极反应________________________________________,碘化钠的作用是_______________________________________________________________。
查看习题详情和答案>>1-丙醇
| ① |
| ② |
| ③ |
| ④ |
| ⑤ |
已知:CH2═CHCH3+Cl2
| 500℃ |
(1)写出①-④各步反应的化学方程式,并分别注明其反应类型.
①
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
②
| 500℃ |
| 500℃ |
③
④
| NaOH |
| △ |
| NaOH |
| △ |
(2)如果所用1-丙醇中混有2-丙醇,对所制丙烯的纯度是否有影响?简要说明理由:
(3)完成下列反应方程式
①1-丙醇与氧气在铜催化剂反应的方程式
| Cu |
| △ |
| Cu |
| △ |
②丙醛与新制氢氧化铜悬浊液共热的方程式
| △ |
| △ |
 某学生设计了如图所示的装置进行实验,各装置中所装试剂、实验操作及实验现象如下:
某学生设计了如图所示的装置进行实验,各装置中所装试剂、实验操作及实验现象如下:Ⅰ.装置中所装的试剂是:①A瓶装无水乙醇,内放无水盐X;②B干燥管中装生石灰;③C和D中都装浓硫酸;④E瓶中装入试剂Y
Ⅱ.实验操作及现象是:用水浴加热A瓶;将D中浓硫酸缓缓滴入E中与试剂Y作用;发现C中导管有大量气泡放出;A瓶内X逐渐变色,从B管挥发出的气体可点燃.
请回答下列问题:
(1)E瓶中所装的试剂Y是
a.饱和食盐水 b.MnO2和NaCl的混合物 c.浓盐酸
(2)C中浓H2SO4所起的作用是
(3)A瓶中发生反应的化学方程式是
| △ |
| △ |
(4)无水盐X宜选用
(5)此实验能证明乙醇分子中含有氧原子的理由是
(6)如果将装置中的C瓶去掉,实验目的是否能够达到?
(1)前三周期元素中第一电离能最小的是 _______ (填元素符号),其基态原子的电子排布式为 _______ 。第二周期非金属元素形成的氢化物中化学键极性最大的是 _______
(填分子式),该物质在CCl4中的溶解度比在水中的溶解度 _______ (填“大”或“小”)。
 |
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是 _______ (填物质字母代号)。
(3)晶格能的大小:MgO _______ NaCl,键能的大小:HBr _______ HI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是 _______
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4 > CBr4 > CCl4 > CH4
C.SiF4 > NaF > NaCl > NaBr
B《实验化学》
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度 / ℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
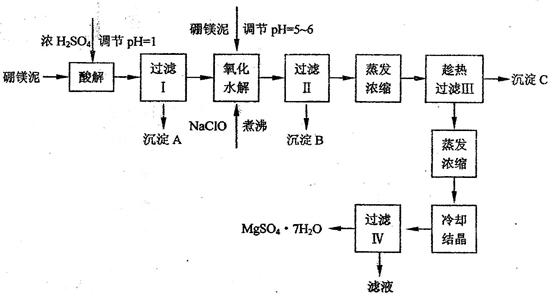
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 _______ 。加热煮沸的主要目的是_ _______ 。
(2)沉淀B中除MnO2、SiO2外还含有 _______ (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 _______ ;
(4)沉淀C的化学式是 _______ 。过滤II需趁热过滤的理由是 _______
A.《物质结构与性质》
(1)前三周期元素中第一电离能最小的是 _______ (填元素符号),其基态原子的电子排布式为 _______ 。第二周期非金属元素形成的氢化物中化学键极性最大的是 _______
(填分子式),该物质在CCl4中的溶解度比在水中的溶解度 _______ (填“大”或“小”)。
 |
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是 _______ (填物质字母代号)。
(3)晶格能的大小:MgO _______ NaCl,键能的大小:HBr _______ HI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是 _______
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4 > CBr4 > CCl4 > CH4
C.SiF4 > NaF > NaCl > NaBr
B《实验化学》
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度 / ℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
硼镁泥制取七水硫酸镁的工艺流程如下:

根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 _______ 。加热煮沸的主要目的是_ _______ 。
(2)沉淀B中除MnO2、SiO2外还含有 _______ (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 _______ ;
(4)沉淀C的化学式是 _______ 。过滤II需趁热过滤的理由是 _______
查看习题详情和答案>>