17.(12分)⑴有人研究证明:使用氯气作自来水消毒剂,氯气会与水中有机物反应,生成如CHCl3等物质,这些物质可能是潜在的致癌致畸物质。目前人们已研发多种饮用水的新型消毒剂。下列物质不能作自来水消毒剂的是 (填序号)。
A.硫酸铜 B.二氧化氯 C.臭氧 D.硫酸亚铁
⑵高铁(VI)酸盐(如Na2FeO4)是新一代水处理剂。其制备方法有:次氯酸盐氧化法(湿法)和高温过氧化物法(干法)等。湿法是在碱性溶液中用次氯酸盐氧化铁(III)盐,写出该法的离子方程式:
。
⑶用高铁(VI)酸盐设计的高铁(VI)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应:3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH
①写出正极发生的电极反应式: 。
②用高铁(VI)电池作电源,以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,当电池中有0.2molK2FeO4反应时,则在电解池中生成H2 L(标准状况)。
③下表列出了某厂排放的含锌废水中的含量及国家环保标准值的有关数据:
|
|
某厂含锌废水水质 |
国家环保标准值 |
|
Zn2+浓度/(mg·L-1) |
≤800 |
≤3.9 |
|
pH |
1-5 |
6-9 |
该厂只用调节pH处理废水,当调整为pH=7时,此时废水中Zn2+的浓度为 mg/L,
(填“符合”或“不符合”)国家环保标准。(常温下,Ksp[Zn(OH)2]=1.2×10-17)
15.(10分)“烂板液”是制印刷锌板时,用稀HNO3腐蚀锌板后得到的废液,主要含Zn(NO3)2和由自来水带进的Cl-、Fe3+等杂质离子。在实验室中由“烂板液”制取ZnSO4·7H2O的过程如下:
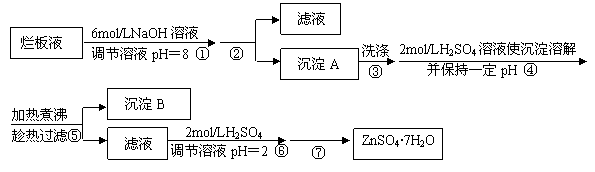
w.w.^w.k.&s.5*高.考.资.源.网
已知有关金属离子形成氢氧化物沉淀时的pH见下表:
|
离子 |
开始沉淀时的pH |
完全沉淀时的pH |
|
Fe3+ |
1.9 |
3.2 |
|
Zn2+ |
6.4 |
8.0 |
⑴沉淀B的主要成分是 。
⑵第②步操作中需要的玻璃仪器有 。
⑶第④步中pH应保持在 范围内。
⑷第⑥步调节溶液pH=2的目的是 。
⑸操作⑦包含3个基本实验操作,它们是蒸发浓缩、 和过滤。
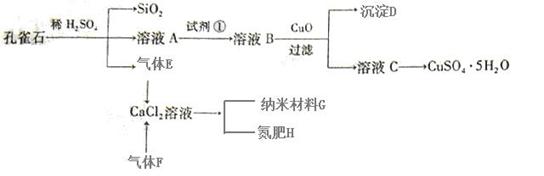
10.某无色溶液含有①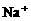 、②
、②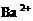 、③
、③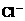 、④
、④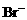 、⑤SO32-、⑥SO4 2-离子中的若干种,依次进行下列实验。且每步所加试剂均过量,观察到的现象如下:
、⑤SO32-、⑥SO4 2-离子中的若干种,依次进行下列实验。且每步所加试剂均过量,观察到的现象如下:
|
步骤 |
操作 |
现象 |
|
⑴ |
用pH试纸检验 |
溶液的pH大于7 |
|
⑵ |
向溶液中滴加足量氯水,再加入CCl4振荡,静置 |
CCl4 层呈橙色 |
|
⑶ |
向所得水溶液中加入足量Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
|
⑷ |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是
A.肯定含有的离子是③④⑥ B.肯定含有的离子是①④⑤
C.不能确定的离子是①③⑤ D.肯定没有的离子是②③⑤
 w.w.^w.k.&s.5*高.考.资.源.网
w.w.^w.k.&s.5*高.考.资.源.网 (10分)I 实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
(10分)I 实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
 CaS +4CO↑
CaS +4CO↑ aTiCl4 + cCO ……反应①
aTiCl4 + cCO ……反应① Ti + 2MgCl2 ……反应②
Ti + 2MgCl2 ……反应②