25、工业制硝酸的主要反应是:
4NH3(g)+5O2(g)
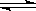 4NO(g)+6H2O (g)+Q;Q =1025 kJ·mol-1
4NO(g)+6H2O (g)+Q;Q =1025 kJ·mol-1
(1)该反应的平衡常数表达式为K=________________;升高温度K值__________ (填“增大”、“减小”或“不变”)。
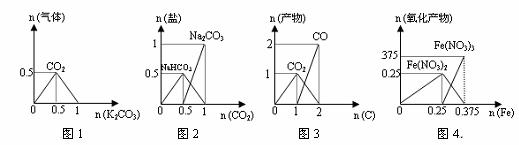
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填序号)。
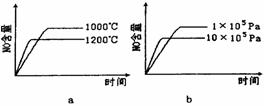
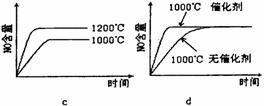
(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
|
时间/浓度 |
c(NH3)(mol/L) |
C(O2)(mol/L) |
C(NO)(mol/L) |
|
起始 |
0.8 |
1.6 |
0 |
|
第2min |
0.6 |
a |
0.2 |
|
第4min |
0.3 |
0.975 |
0.5 |
|
第6min |
0.3 |
0.975 |
0.5 |
|
第8min |
0.8 |
1.6 |
0.5 |
①起始时物料比c (O2):c (NH3)>1.25,其原因是____________________________。
②反应在第2min到第4min时O2的平均反应速率为______________ mol/L·min;
③反应在第2min改变了反应条件,改变的条件可能是 ________ (填序号)
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是___________________________________。
23、下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为[填元素符号]_______________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是[填化学式]________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4) 由②和④组成,且②和④的质量比为3∶8的化合物的结构式是 ,
其中含________键,(填“极性”或“非极性”下同)属于________分子
该物质与⑤的同周期相邻主族元素的单质反应的化学方程式为 __
(5) ⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为 。
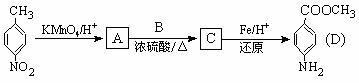
 C的反应类型是 : 。
C的反应类型是 : 。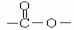
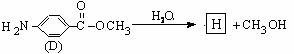 (6)D的水解反应如下:
(6)D的水解反应如下: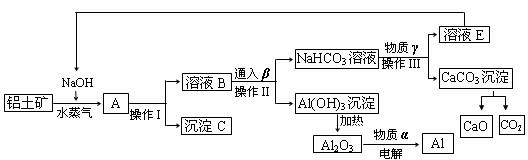
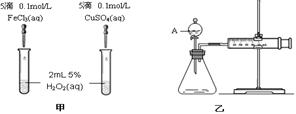 为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题: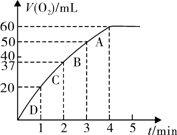 (3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。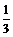 气体所需时间为 min。
气体所需时间为 min。 气体所需时间约为
min。
气体所需时间约为
min。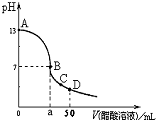 B.在B点,a<25,且有c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
B.在B点,a<25,且有c(Na+)=c(CH3COO-)>c(OH-)=c(H+)