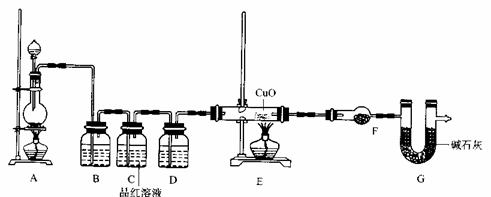
0 41654 41662 41668 41672 41678 41680 41684 41690 41692 41698 41704 41708 41710 41714 41720 41722 41728 41732 41734 41738 41740 41744 41746 41748 41749 41750 41752 41753 41754 41756 41758 41762 41764 41768 41770 41774 41780 41782 41788 41792 41794 41798 41804 41810 41812 41818 41822 41824 41830 41834 41840 41848 447348
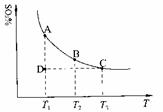
 (1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: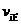
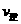 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)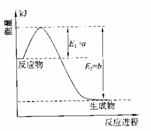 (2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。 )
)
 (4)I元素在周期表里的位置在第 周期、第 族。
(4)I元素在周期表里的位置在第 周期、第 族。 )
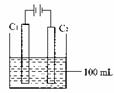
) (13分)实验室中需要22.4 l(标准状况)SO2气体。化学小组同学依据化学方程式Zn+
(13分)实验室中需要22.4 l(标准状况)SO2气体。化学小组同学依据化学方程式Zn+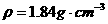 )110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
)110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质。