32.(8分)(化学一物质结构与性质)
A、T、X、Y、z是中学化学常见的四种元素,原子序数依次增大,其结构或性质信息如下表:
|
元素 |
结构或性质信息 |
|
T |
基态原子的L层上s电子数等于p电子数 |
|
X |
基态原子最外层未成对电子数在该元素所在周期中最多 |
|
Y |
基态原子的第一电离能在该元素所在周期中最小 |
|
Z |
单质常温、常压下是气体。基态原子的M层上有1个未成对的p电子 |
请根据信息回答有关问题(答题时如需表示具体元素,请用相应的元素符号):
(1)T、X、Z三种元素的电负性由大到小的顺序是 。
(2)写出与x单质分子互为等电子体的物质的化学式 、 。
(分子、离子各一种)
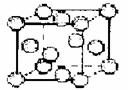 (3)元素Q的原子序数是Y与Z的原子序数之和。
(3)元素Q的原子序数是Y与Z的原子序数之和。
①元素Q与元素T、x能形成平面型的[Q(TX)4]2-离子。
TX-中T原子采用的轨道杂化方式是 。
②Q单质的晶胞如右图甲所示,Q单质中Q原子的配位数为
。
30.(12分)I、某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
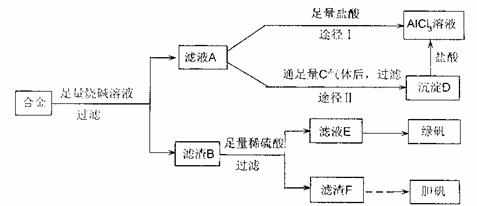
试回答下列问题:
(1)由滤液A制得AlCl3,溶液有途径I和Ⅱ两条,选择其中的合理途径的理由是:
。
(2)从经济效益和环境保护角度考虑,用滤渣F制备胆矾溶液的化学方程式:
。
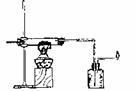
Ⅱ、某校化学研究性学习小组,在学习金属的冶炼以后,对一氧化碳还原金属氧化物的实验非常感兴趣,他们查阅有关资料后分析:
(1)学生对相关装置进行分析和比较发现这些装置既有各自的优点,同时也发现各个装
置中均存在一些不足,具体看下表:
|
人教版、广东版、山东版 |
上海科学技术出版社 |
2005(7-8)化学教学杂志 |
||
|
|
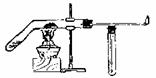
(2)在上述实验的基础上某学生设计了一氧化碳还原氧化铁相对更为合理的实验,重点
避免了上述三个不足。其中一氧化碳是利用甲酸和浓硫酸共热到60-80℃可发生脱水反应得到:

HCOOH CO↑+H2O
请根据以下各装置进行选择组成-套相对较为合理的实验装置图(某些装置可重复使用)
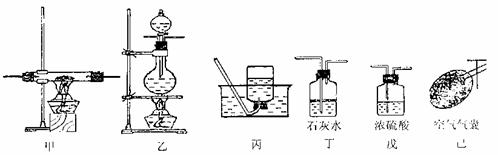
(3)回答以下问题:
①该实验装置合理的连接顺序是:己→乙→ → → → 丙
②在反应时先产生一氧化碳气体,过一会再点燃加热氧化铁的酒精灯,原因是
(填选项,多选扣分)
A.因为一般反应从左到右进行
B.排除体系内的空气,使反应过程更安全 .
C.甲酸与浓硫酸反应可以产生大量的CO气体
D.此反应加热时间长有利于产生CO
③观察到硬质玻璃管中红棕色粉末变为黑色时停止加热,然后继续 ,以防止铁被氧化。
④硬质玻璃管中发生反应的化学方程式是 。
29.(14分)下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,回答下列问题:
 族
族周期 |
I A |
ⅡA |
ⅢA |
ⅣA |
VA |
ⅥA |
ⅦA |
0 |
|
一 |
① |
|
||||||
|
二 |
|
|
|
② |
③ |
④ |
|
|
|
三 |
⑤ |
|
⑥ |
⑦ |
|
⑧ |
|
|
(1)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 (写化学式)。
(2)由表中元素可以组成多种漂白剂,试写出其中两种常用漂白剂的化学式: 、
。
(3)①、④、⑤三种元素形成的化合物中化学键的类型: 。
(4)②和④形成的化合物与④和⑤形成的化合物之间发生氧化还原反应,写出该反应的
化学方程式: 。
 (5)由表中元素形成的常见物质X、Y、Z、M、W可发生以下反应:
(5)由表中元素形成的常见物质X、Y、Z、M、W可发生以下反应:
①X溶液与Y溶液反应的离子方程式为 ;
②已知M为硝酸盐,则M溶液中各离子浓度由大到小排列顺序为:c( )>c( )>c( )>c( )(在括号内填离子符号)。
 2.下列说法中.正确的是 ( )
2.下列说法中.正确的是 ( )
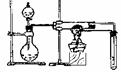
 使用的人工固氮方法:N2(g)+3H2(g)
2NH3(g)。请回答:
使用的人工固氮方法:N2(g)+3H2(g)
2NH3(g)。请回答: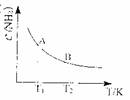 (1)已知:H-H键能为436kJ/mol,NN键能为945kJ/mol,
(1)已知:H-H键能为436kJ/mol,NN键能为945kJ/mol,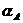 平衡时,混合气体中氨占25%,试回答:
平衡时,混合气体中氨占25%,试回答: ②右图中:在状态A时,平衡常数KA
(代入数
②右图中:在状态A时,平衡常数KA
(代入数