24.[化学--化学与技术](12分)
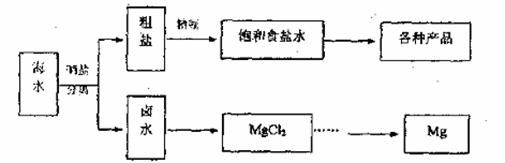 海水中蕴藏着丰富的资源,海水综合利用的流程图如下。
海水中蕴藏着丰富的资源,海水综合利用的流程图如下。
(1)用NaCl做原料可以得到多种产品。
①工业上由NaCl制备金属钠的化学方程式是 。
②实验室用惰性电极电解100mL0.1 mol/L NaCl溶液,若阴阳两极均得到112mL气体(标准状况),则所得溶液的pH为 (忽略反应前后溶液的体积变化)。
③电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式: 。
(2)分离出租盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。
①粗产品的溶液中含有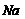 、
、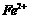 、
、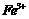 和
和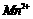 ,需将
,需将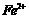 、
、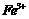 、
、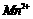 转化为沉淀除去。Fe(OH)2呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表)。若只加一种上述(1)中得到的产品,该物质的化学式为
,控制溶液的pH为
。
转化为沉淀除去。Fe(OH)2呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表)。若只加一种上述(1)中得到的产品,该物质的化学式为
,控制溶液的pH为
。
|
物质 |
开始沉淀 |
沉淀完成 |
|
Fe(OH)3 |
2.7 |
3.7 |
|
Fe(OH)2 |
7.6 |
9.6 |
|
Mn(OH)2 |
8.3 |
9.8 |
|
Mg(OH)2 |
9.6 |
11.1 |
若只加一种上述(1)中得到的产品,该物质的化学式为 ,控制溶液的pH为 。
②在家用电热水器不锈钢内胆表面镶嵌镁棒,利用电化学原理来防止内胆腐蚀,写出正极的电极反应式: 。
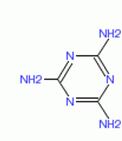 2008年9月,中国爆发三鹿毒奶粉事件,其原因是奶粉中含有三聚氰胺。三聚氰胺是一种重要的有机化工原料。它的结构简式如右图,
2008年9月,中国爆发三鹿毒奶粉事件,其原因是奶粉中含有三聚氰胺。三聚氰胺是一种重要的有机化工原料。它的结构简式如右图, D.三聚氰胺含氮量很高,能冒充蛋白质通过检验
D.三聚氰胺含氮量很高,能冒充蛋白质通过检验
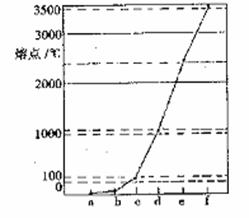 下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。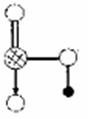 (2)单质a、f对应的元素以原子个数比1:1形成的分子中含
个
(2)单质a、f对应的元素以原子个数比1:1形成的分子中含
个 键, 个
键, 个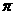 键。
键。
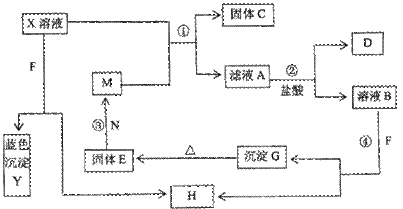 23.(12分)已知X为中学化学中的一种常见的盐,F为淡黄色固体:M、N为常见的金属,N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的轴承;H为气体单质、D为无色气体;在空气中会出现红棕色。各物质的转化关系如下图(部分反应产物已略去)。
23.(12分)已知X为中学化学中的一种常见的盐,F为淡黄色固体:M、N为常见的金属,N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的轴承;H为气体单质、D为无色气体;在空气中会出现红棕色。各物质的转化关系如下图(部分反应产物已略去)。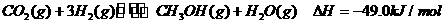
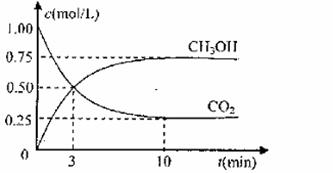 测得CO2和CH3OH(g)的浓度随时间变化如图所示。
测得CO2和CH3OH(g)的浓度随时间变化如图所示。