25.(5分)某学生做元素性质递变实验时自己设计了一套方案,并记录了有关实验现象如下表:
|
实验方案 |
实验现象 |
|
1.用砂纸打磨后的镁带与水反应,再向反应后的溶液中滴加酚酞 |
(A)浮在水面上,迅速熔化化成光亮小球,四处浮动,最终消失,溶液变红 |
|
2.向新制的氢硫酸饱和溶液中滴加新制的氯水 |
(B)产生气体,可在空气中燃烧,溶液变成浅红色 |
|
3.钠与滴有酚酞试液的冷水反应 |
(C)反应不十分强烈,产生的气体可在空气中燃烧 |
|
4.镁带与2mol/L的盐酸反应 |
(D)剧烈反应,产生可燃性气体 |
|
5.铝条与2mol/L的盐酸反应 |
(E): |
|
6.向氯化铝溶液中滴加氢氧化钠溶液至过量 |
(F)生成黄色沉淀 |
请你帮助该同学完成实验报告:[
(1)实验目的:探究同周期元素的金属性和非金属性的递变规律 。
(2)实验仪器:① ②胶头滴管 ③试管 ④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸等
(3)实验内容:与实验方案1-6对应的实验现象依次为 (填:字母编号)。
实验现象(E)为: 。
(4)实验结论 。
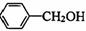 1分
1分
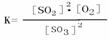 (1) (1分)
(1) (1分) (3)先将铜与浓硫酸反应产生的气体X持续通入右下图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括(可选多项,但多选倒扣分,下同)
(3)先将铜与浓硫酸反应产生的气体X持续通入右下图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括(可选多项,但多选倒扣分,下同)
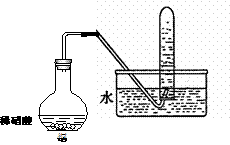 E.BaSO4不溶于水也不溶于HNO3溶液
E.BaSO4不溶于水也不溶于HNO3溶液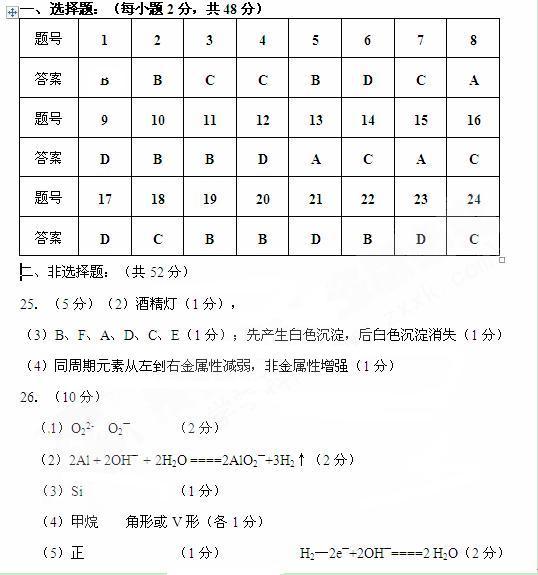
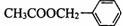 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下: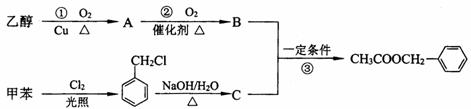
 2SO2(g)+ O2(g);△H >0,其中SO3的变化如下图所示:
2SO2(g)+ O2(g);△H >0,其中SO3的变化如下图所示: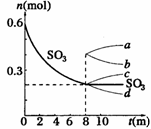 (3)升高温度,该反应的反应速率将
;K值将
;容器中气体的平均相对分子质量将
。(填“增大”“减小”或“不变”)
(3)升高温度,该反应的反应速率将
;K值将
;容器中气体的平均相对分子质量将
。(填“增大”“减小”或“不变”)