0 41610 41618 41624 41628 41634 41636 41640 41646 41648 41654 41660 41664 41666 41670 41676 41678 41684 41688 41690 41694 41696 41700 41702 41704 41705 41706 41708 41709 41710 41712 41714 41718 41720 41724 41726 41730 41736 41738 41744 41748 41750 41754 41760 41766 41768 41774 41778 41780 41786 41790 41796 41804 447348
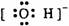 C.
C. 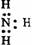 D.
D. 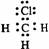


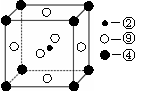 (2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的

 例如:PdCl2 + CO + H2O=Pd↓+ CO2 +2HCl 。反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。
例如:PdCl2 + CO + H2O=Pd↓+ CO2 +2HCl 。反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。
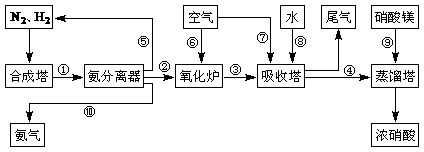
 CO2+H2
CO2+H2 (2)合成塔中发生反应N2(g)+3H2(g)
(2)合成塔中发生反应N2(g)+3H2(g) (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应: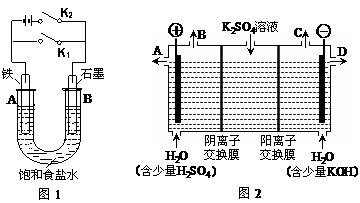
 B.
B. C.
C.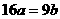 D.
D.