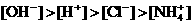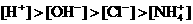19、Ⅰ(10分) A、B、C、D四种元素在周期表中分别处于元素X的四周(如下图),已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的。试确定:
(1)各元素的符号:
A:_____,B:____,C:____,D:_____,X:_____。
(2)写出C、D、X最高价氧化物对应水化物的化学式,并排列酸性由强到弱的顺序:___________。
(3)写出A、B、X气态氢化物的化学式,并排列稳定性由强到弱的顺序:__________________。
Ⅱ(8分)Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+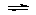 2Fe2++I2(水溶液),
2Fe2++I2(水溶液),
⑴该反应的平衡常数K的表达式为:K= ___________________________
[物质的浓度用“c(物质)”表示]。当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡________移动(填“向右”、“向左”、“不”)。
⑵上述反应的正向反应速率和I-、Fe3+的浓度关系为:v=K[c(I-)]m[c(Fe3+)]n(其中K为常数)
|
|
c(I-)(mol/L) |
c(Fe3+)(mol/L) |
v[mol/(L·s)] |
|
⑴ |
0.20 |
0.80 |
0.032K |
|
⑵ |
0.60 |
0.40 |
0.144K |
|
⑶ |
0.80 |
0.20 |
0.128K |
通过所给的数据计算得知:
①在v=K[c(I-)]m[c(Fe3+)]n中,m、n的值为_________。
A. m=1、n=1 B. m=1、n=2 C. m=2、n=1 D. m=2、n=2
②I-浓度对反应速率的影响_______Fe3+浓度对反应速率的影响(填“>”、“<”或“=”)。



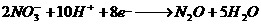
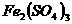 、
、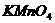 、
、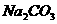 、
、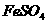 四种物质中的一种物质能使上述还原过程发生。
四种物质中的一种物质能使上述还原过程发生。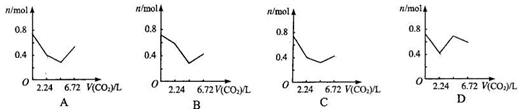
 ,
,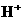 ,
, 和
和 四种离子,其浓度大小有如下关系,其中可能的是
(
)
四种离子,其浓度大小有如下关系,其中可能的是
(
)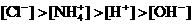 ②
②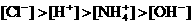
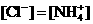 且
且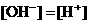 ④
④