23、(13分)为了回收利用SO2,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体的生产流程,其流程示意图如下:

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时的pH见下表:
|
离子 |
开始沉淀时的pH |
完全沉淀时的pH |
加碱溶解的pH |
|
Fe2+ |
7.6 |
9.7 |
|
|
Fe3+ |
2.7 |
3.7 |
|
|
Al3+ |
3.8 |
4.7 |
>8.5 |
|
Mn2+ |
8.3 |
9.8 |
|
请回答下列问题:
(1)写出浸出过程中主要反应的化学方程式:______________________________________。
(2)写出氧化过程中主要反应的离子方程式:______________________________________。
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至_______________________。
(4)滤渣的主要成分有_________________________________________。
(5)下列各组试剂中,能准确测定尾气中SO2含量的是__________。(填编号)
a. NaOH溶液、酚酞试液 b. 稀H2SO4酸化的KMnO4溶液
c. 碘水、淀粉溶液 d. 氨水、酚酞试液
(6)已知废气中SO2浓度为6.4 g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000 m3废气,可得到硫酸锰晶体质量为___________________kg。
22、( 15分)A、B、C三种化合物,都是由氢、氮、氧三种元素所组成,,其中一种是弱电解质,余均是强电解质。A和B可以通过复分解反应形成C。常温,浓度均为a mol·L-1的A、B、C三种稀溶液中,pH大小关系是pH(B)> pH(C)> pH(A)。
(1)写出物质的化学式:A: B: C: 。
(2)A、B、C三种物质各自溶解在水中时,能使水的电离程度增大的是 ,
对应的离子方程式为: 。
(3)若将a mol·L-1的B溶液进行下列实验,将变化填写在对应表格中
|
项目 |
溶液中c(H+) |
溶液中c(OH-) |
对B电离的影响 |
|
取1mL用蒸馏水稀释为100mL溶液 |
|
|
|
|
取1mL用同浓度的C溶液稀释为100mL溶液 |
|
|
|
21、(16分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为______________________(用元素符号表示)。
(2)①、②、④、⑤中的三种元素形成的某无机盐的用途是(举出一例即可) ;由这四种元素形成的某盐的式量为82,该盐的水溶液呈_______性,理由是(用离子方程式解释)____________________________________________________。
(3)由表中④、⑤两种元素的原子按1:1组成的化合物的电子式_________________。
由1mol该物质与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 。
A.NaOH Na2CO3 B.Na2CO3 C.Na2O2 Na2CO3 D.Na2O2 NaOH Na2CO3
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
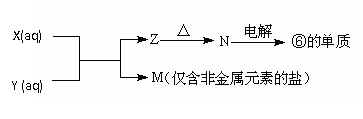
X溶液与Y溶液反应的离子方程式为___________________________________,常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至____________(填酸性、碱性或中性)。
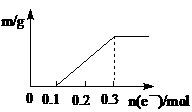 以Pt为电极,电解含有0.10mol Cu2+和0.10mol M3+的溶液,阴极析出固体物质的质量m(g)与溶液中通过电子的物质的量n(mol)的关系见图示。则离子的氧化能力由大到小排列正确的是(
)
以Pt为电极,电解含有0.10mol Cu2+和0.10mol M3+的溶液,阴极析出固体物质的质量m(g)与溶液中通过电子的物质的量n(mol)的关系见图示。则离子的氧化能力由大到小排列正确的是(
)