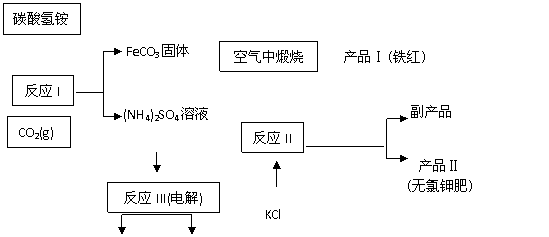
32.(16分) 以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵[(NH4)2S2O8]和氧化铁红颜料, 原料的综合利用率较高。其主要流程如下:
 |
|||
|
|||
|

(1)①反应I前需在FeSO4 溶液中加入 ,以除去溶液中的Fe3+;
②反应I需控制反应温度低于35℃,其目的是 。
(2) ①反应II所得的副产品是 ;试写出该副产品的一种用途为 。
②检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,
。
(3)煅烧FeCO3生成产品I的化学反应方程式为________________________。实验室进行煅烧操作所需仪器除了酒精灯、泥三角、三脚架、玻璃棒外,还有 。
(4)反应III常被用于电解生产(NH4)2S2O8 (过二硫酸铵)。电解时均用惰性电极,阳极 发生的电极反应可表示为: 。
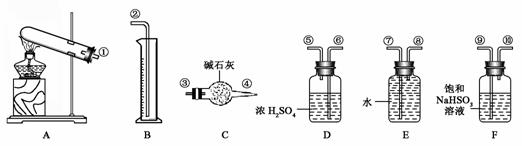
30.(17分)硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、二种或三种。某化学课外活动小组通过设计一探究性实验,探索测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验可能用到的仪器如下图所示:
[提出猜想]
Ⅰ.所得气体的成分可能只含 一种;
Ⅱ.所得气体的成分可能含有 二种;
Ⅲ.所得气体的成分可能含有 三种。
[实验探究]
实验操作过程(略)。已知实验结束时,硫酸铜完全分解。请回答下列问题:
(1) 请你组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为:
__ (填序号)
(2) 若实验结束,B中量筒没有收集到水,则证明猜想 正确。
(3)若实验结束,经测定装置C的总质量增加了,能否肯定气体产物中含有SO2而不含SO3?
请说明理由。答:
(4)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后,测得相关数据也不同,数据如下:
|
实验小组 |
称取CuSO4 的质量(g) |
装置C增加 的质量(g) |
量筒中水的体积折算成标 准状况下气体的体积(mL) |
|
一 |
6.4 |
2.56 |
298.7 |
|
二 |
6.4 |
2.56 |
448 |
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学反应方程式:
一组:_____________ ;
二组:_ 。
(5)该实验设计中,由于实验操作的原因容易给测定带来最大误差的两个仪器是________和_______(填代号)。
10.短周期元素W、X、Y、Z在元素周期表中的位置如右图所示。下列说法中,正确的是
|
|
X |
|
|
|
Y |
|
|
Z |
W |
|
A.Y的原子半径在同周期主族元素中最大
B.W的最高价氧化物对应的水化物是强酸
C.W的非金属性比Z的弱
D.Z的气态氢化物的稳定性在同主族元素中最强
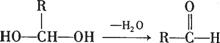 (16分)已知一个碳原子上连有两个羟基时,其结构极不稳定,易发生下列变化,生成较稳定物质: 如:
(16分)已知一个碳原子上连有两个羟基时,其结构极不稳定,易发生下列变化,生成较稳定物质: 如:
 HCO3-+H+ 的平衡常数K =
。(已知:10-5.6=2.5×10-6)
HCO3-+H+ 的平衡常数K =
。(已知:10-5.6=2.5×10-6) .关于下列四个图像的说法中不正确的是
.关于下列四个图像的说法中不正确的是 
 CO2(g)+ H2(g) ΔH <0
CO2(g)+ H2(g) ΔH <0