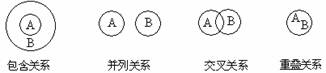
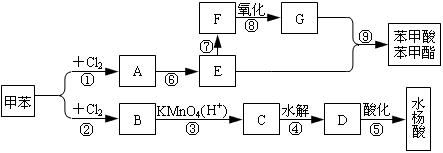
0 41543 41551 41557 41561 41567 41569 41573 41579 41581 41587 41593 41597 41599 41603 41609 41611 41617 41621 41623 41627 41629 41633 41635 41637 41638 41639 41641 41642 41643 41645 41647 41651 41653 41657 41659 41663 41669 41671 41677 41681 41683 41687 41693 41699 41701 41707 41711 41713 41719 41723 41729 41737 447348
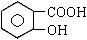
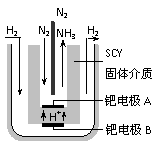 ⑹随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如右图)。
⑹随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如右图)。