4.下列实验可行的是
A.加入适量铜粉除去Cu(NO3)2溶液中的AgNO3杂质
B.用NaOH溶液除去CO2中混有的HCl气体
C.用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质
D.用乙醇从碘水中萃取碘
19.(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题,并在相应的答题区域内做答。若两题都做,将按A题评分。
A.纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+1价的化合物。
 (1)写出基态
(1)写出基态 的核外电子排布式
;
的核外电子排布式
;
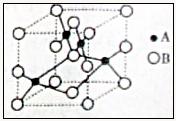
(2)右图是铜的某种氧化物的晶胞示意图,该氧化物
的化学式为 ;
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水到
沉淀刚好全部溶解可得到森蓝色溶液,继续向其中加入极
性较小的乙醇可以生成深蓝色的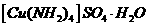 沉淀,该物质中的
沉淀,该物质中的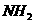 通过
键与中心离子
通过
键与中心离子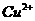 结合,
结合,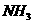 分子中N 原子的杂化方式是
。与
分子中N 原子的杂化方式是
。与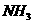 分子互为等电子体的一种微粒是
。
分子互为等电子体的一种微粒是
。
(4)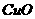 的熔点比
的熔点比 的熔点
。(填“高”或“低”)
的熔点
。(填“高”或“低”)
B.目前市场上大量碳酸饮料、矿泉水、食用油等产品包装瓶几乎都是用PET(聚对苯二甲酸乙二醇脂,简称聚酯)制作的。某科学小组利用费聚酯饮料瓶制备对苯二甲酸。部分有机物的性质如下:
|
名称 |
性质 |
|
乙二醇 |
无色粘稠吸湿液体,易燃,沸点:196-198℃,与水混溶。 |
|
丙酮 |
无色易燃液体,沸点:56.5℃,溶于水及大多数有机溶剂。 |
|
N,N二甲基甲酰胺(DMF) |
易燃,低毒,沸点:153℃,能与水和大多数有机溶剂混溶。 |
|
对苯二甲酸(TPA) |
白色针状结晶或粉末,可燃,熔点:425℃(分解),约在300℃升华,不溶于水,微溶于热乙醇,溶于碱溶液。电离常数: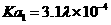 , ,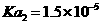 |
实验过程如下,试回答下列问题:
(1)对苯二甲酸的制备
① 在100mL四颈瓶上分别装置冷凝管、搅拌器和温度计。然后依次加入5.00g废饮料瓶碎片、0.05g氧化锌、5g碳酸氢钠和25mL乙二醇。缓慢搅拌,油浴加热,将温度升至180℃(不超过185℃),在此温度下反应15分钟。
反应过程中的现象是 。
② 冷却至160℃左右停止搅拌,将搅拌回流装置改成搅拌、减压蒸馏装置,减压蒸馏。这一步是为了分离出 。
③ 向四颈瓶中加入50mL沸水,搅拌使四颈瓶中的残留物溶解。抽滤除去少量不溶物。抽滤需要用到的主要仪器有 。
④ 将滤液转移到400mL烧杯中,用25mL水荡洗滤瓶并倒入烧杯中,再添加水使溶液总体积达200mL丙酮分2次洗涤,抽干,干燥。
(2) 对苯二甲酸含量的测定
称取0.2000g对苯二甲酸样品于250mL烧杯中,加入30mL DMF,搅拌溶解,加入10 mL蒸馏水,搅匀后加4滴酚酞指示剂,用0.1000 mol·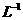 氢氧化钠标准溶液滴定,消耗氢氧化钠标准溶液体积为22.60mL。
氢氧化钠标准溶液滴定,消耗氢氧化钠标准溶液体积为22.60mL。
滴定终点的现象是 。
所测样品中对苯二甲酸的质量分数为 。


18.(10分)一般情况下,当人体一次性摄取300mg-500mg亚硝酸钠时,就会引起中毒。某研究小组用碘量法测定泡菜中亚硝酸盐的含量。有关反应如下:
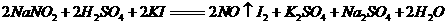

取1kg泡菜,榨汁,将榨出的液体收集后,加入提取剂和氢氧化钠,使得到的泡菜汁中的亚硝酸盐都成为要硝酸钠。在过滤后的滤液中加入氢氧化铝乳液,以除去色素。再次过滤后得到滤液,将该滤液稀释至1L,取25.00mL稀释后的滤液与过量的稀硫酸和碘化钾溶液反应,在选用合适的指示剂,用0.05000mol·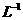
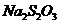 标准溶液进行滴定。实验数据记录如下;
标准溶液进行滴定。实验数据记录如下;
|
滴定次数 |
0.05000mol·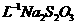 标准溶液体积/mL 标准溶液体积/mL |
|
|
滴定前刻度 |
滴定后刻度 |
|
|
1 |
0.00 |
20.04 |
|
2 |
0.12 |
20.08 |
|
3 |
0.05 |
20.05 |
请回答下列问题:
(1)该实验中可选用的指示剂是 ,滴定终点的现象是 。
(2)有经验的厨师在做泡菜时往往加入适量的橙汁,以减轻亚硝酸盐的危害。这主要是因为橙汁中含有丰富的维生素C,维生素C具有 性(填“氧化性”或“还原性”)
(3)通过计算判断若某人遗一次食入0.125kg这种泡菜,是否会引起中毒?
 2C(g)+D(g);△H<0。现将1molA和2molB加入 甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);△H<0。现将1molA和2molB加入 甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
 A.羊毛和聚酯纤维在一定条件下均可水解
A.羊毛和聚酯纤维在一定条件下均可水解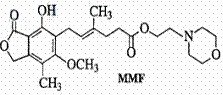 3.霉酚酸酯(MMF)是器官移植中抑制细胞增殖
3.霉酚酸酯(MMF)是器官移植中抑制细胞增殖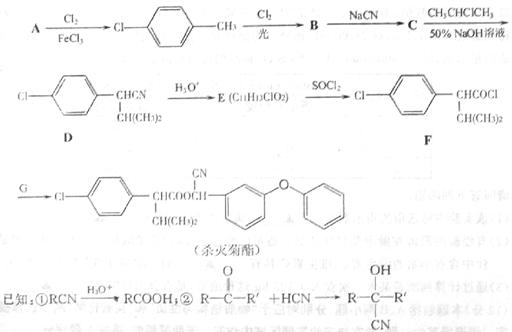
 溶液反应放出
溶液反应放出 气体
气体 醇溶液共热不能发生消去反应;
醇溶液共热不能发生消去反应;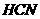 加成制得,写出合成G的化学方程式 。
加成制得,写出合成G的化学方程式 。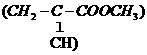
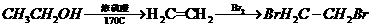
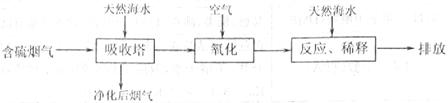
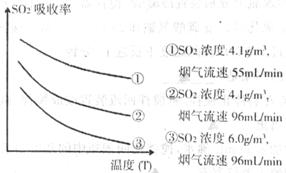
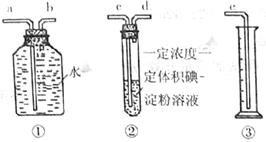
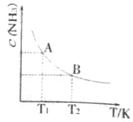 (10分)
(10分) ”、 “
”、 “ ”
”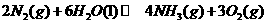
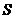 0(填“
0(填“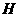 。
。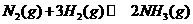 △
△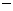 92.4kJ/mol
92.4kJ/mol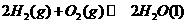 △
△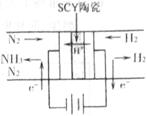 (3)科学家采用高质子导电性的SCY陶瓷(可传递H+),实现了
(3)科学家采用高质子导电性的SCY陶瓷(可传递H+),实现了