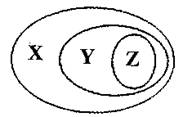
1、下列选项中,可以用图表示物质或概念间的从属关系的是
|
|
X |
Y |
|
||
|
A |
纯净物 |
单质 |
化合物 |
||
|
B |
混合物 |
分散系 |
胶体 |
||
|
C |
元素周期表的纵列 |
主族 |
副族w.&w.^w.k.s.5*u.c.#o |
||
|
D |
有机物 |
烃 |
聚氯乙烯 |
12.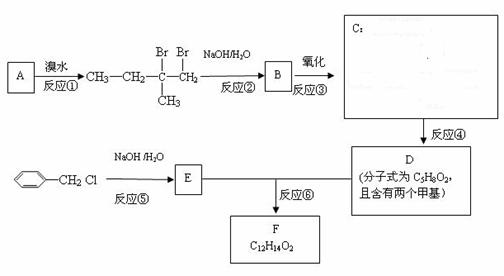 (16分)分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物,某实验室的科技人员设计了下列合成路线:
(16分)分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物,某实验室的科技人员设计了下列合成路线:
|
试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现 种峰;
(2)C物质的官能团名称______;
(3)上述合成路线中属于取代反应的是 (填编号);
(4)写出反应④、⑥的化学方程式(不要求写出反应条件):
④ ,⑥ ;
(5)写出E属于芳香族化合物的所有同分异构体(不含E)的结构简式: 。
7.下表为短周期元素①~⑧的部分性质。
 元素编号 元素编号元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径/10-10m |
0.66 |
1.36 |
1.23 |
1.10 |
0.99 |
1.54 |
0.70 |
1.18 |
|
最高化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
最低化合价 |
-2 |
|
|
-3 |
-1 |
|
-3 |
|
下列说法正确的是
A.元素④⑤形成的化合物是离子化合物
B.元素⑦的气态氢化物稳定性比元素④的气态氢化物稳定性强
C.元素①⑧形成的化合物具有两性
D.上表8种元素中,元素③的最高价氧化物对应水化物的碱性最强
 有关数据: Ba(s)+S(s)+2O2(g)=BaSO4(s);△H = -1473.2 kJ•mol-1
有关数据: Ba(s)+S(s)+2O2(g)=BaSO4(s);△H = -1473.2 kJ•mol-1
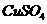 溶液;
溶液;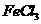 饱和溶液,可以制得
饱和溶液,可以制得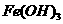 胶体;
胶体; 步骤3加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
步骤3加CCl4,滴加少量氯水,振荡后,CCl4层未变色; SO3(g) △H=-98 kJ·mol-1。
SO3(g) △H=-98 kJ·mol-1。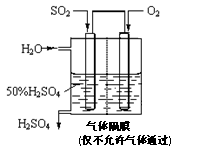 (3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是 (填字母)。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是 (填字母)。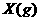

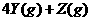 ,
,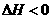 ,在某温度时
,在某温度时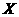 的浓度随时间变化的曲线:
的浓度随时间变化的曲线: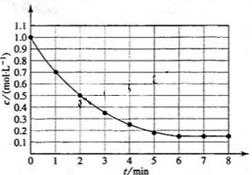 下列有关该反应的描述正确的是
下列有关该反应的描述正确的是 后,反应就终止了
后,反应就终止了