16.(共8分,每空2分)
(1)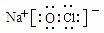
|
(3)2NaCl + 2H2O===2NaOH + H2↑+Cl2↑
(4)2Fe(OH)3 +3ClO- + 4OH- = 2FeO42- +3Cl-+5H2O
18.(10分)现已确认,SO2和NOx的排放是造成酸沉降的两大罪魁祸首。下图表示了某地区在1940~2002年间,空气中SO2和NOx含量因燃料燃烧、工业生产、交通运输以及其他因素的影响而发生变化的基本统计数据。

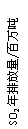


(1)结合上图数据,判断下列说法正确的是( )
A.在交通运输中排放的NOx与燃料的不充分燃烧有关
B.在上世纪60年代以前,在交通运输中排放的SO2主要是使用燃煤的内燃机所致
C.近年来在工业生产中SO2排放量的下降,主要是减少了燃烧的煤的质量
D.随着汽车工业的发展,在形成酸雨的因素中,NOx所占比重在逐渐增大
(2)在上图表示的历史进程中,在工业生产所导致的SO2的排放量明显地在逐年减少。请用化学方程式说明人类在为解决SO2污染问题中所进行的一个反应过程:
_______________________________________________。
(3)汽车排放的尾气中含有未燃烧充分的CH、以及N2、CO2、NO、CO等。有人设计利用反应2NO + 2CO  N2 + 2CO2 将有害的污染物转化为可参与大气循环的N2和CO2。
N2 + 2CO2 将有害的污染物转化为可参与大气循环的N2和CO2。
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
|
时间/h |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)/mol·L-1 |
1.00×10-3 |
4.5×10-4 |
2.5×10-4 |
1.5×10-4 |
1.00×10-4 |
1.00×10-4 |
|
c(CO)/mol·L-1 |
3.6×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
在上述条件下反应能够自发进行,则反应的 0(“>”、“<”、“=”)。前2h内的平均反应速率v(N2)=
_____________,在该温度下,反应的平衡常数K=
。据此你认为将该反应从理论转化为现实的最重要的研究方向是________________________________。
0(“>”、“<”、“=”)。前2h内的平均反应速率v(N2)=
_____________,在该温度下,反应的平衡常数K=
。据此你认为将该反应从理论转化为现实的最重要的研究方向是________________________________。
(4)某次降雨过程收集到10L的雨水,向雨水中滴加1mL6mol/L的H2O2,充分反应后测得溶液的pH=3.62 [c(H+) =2.4×10-4 mol/L ]),再向溶液中加入足量的Ba(OH)2溶液,经过滤、晾干、称重,得沉淀的质量为0.1864g。若假设与水的酸性仅由NOx和SO2的排放所致。请写出将H2O2加入到与水中与含硫化合物反应的离子方程式_____________________________________,并计算排放在空气中的NOx和SO2的物质的量之比接近于__________。
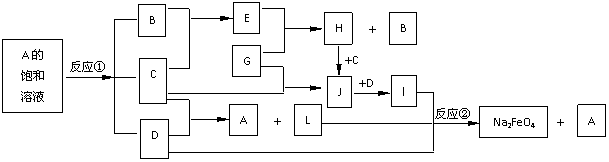
15.(10分)高锰酸钾是锰的重要化合物和常用的氧化剂。以下是实验室中模拟工业上用软锰矿制备高锰酸钾的流程图。
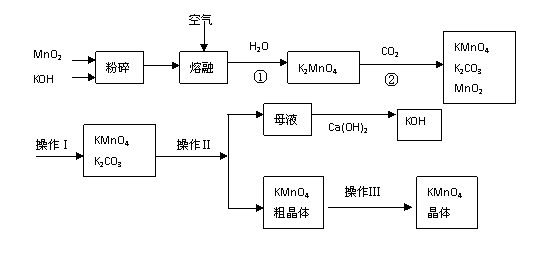

(1)操作Ⅰ的名称为__________;操作Ⅲ的名称为__________。
(2)反应②的化学方程式为 。
工业上用上述原理生产KMnO4方法产率较低,较好的制备方法是电解法。用Pt作阳极,Fe作阴极,K2MnO4为电解液,阳极的电极反应式为 。
(3)KMnO4是一种较稳定的化合物,但日光对KMnO4溶液的分解有催化作用,生成MnO2、KOH和O2。而 MnO2也是该分解反应的一种催化剂,请你设计一个实验方案,验证MnO2对该分解反应具有催化性。简述实验操作、现象及相关结论: 。
(4)KMnO4在酸性介质中的强氧化性广泛应用于分析化学中。
例如:2KMnO4+3H2SO4+5Na2SO3=5Na2SO4+K2SO4+2MnSO4+3H2O。某同学用KMnO4测定实验室长期存放的Na2SO3固体的纯度。现欲准确称取6.3 g Na2SO3固体样品,配成500 mL溶液。取25.00 mL上述溶液放入锥形瓶中,用0.01000 mol/L 的酸性KMnO4溶液进行滴定。滴定结果如下表所示:
|
滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00 mL |
0.02 |
24.01 |
|
2 |
25.00 mL |
0.70 |
24.71 |
|
3 |
25.00 mL |
0.20 |
24.20 |
① 配制500 mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙和__________________、_________________。
② 判断滴定终点的依据是_______________________________。
③ 用上述实验数据,计算Na2SO3的纯度为__________________。


 (13 分)双酚A型环氧树脂是由双酚A、环氧氯丙烷在碱性条件下缩合而成的高分子化合物。具有良好的物理化学性能,被广泛应用于涂料、胶粘剂等领域。根据该树脂的合成路线图示,回答以下问题:
(13 分)双酚A型环氧树脂是由双酚A、环氧氯丙烷在碱性条件下缩合而成的高分子化合物。具有良好的物理化学性能,被广泛应用于涂料、胶粘剂等领域。根据该树脂的合成路线图示,回答以下问题: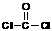 )合成Lexan聚碳酸酯(一种高强材料,可用于制作防弹窗户)。写出此合成反应的化学方程式:_________________________ 。
)合成Lexan聚碳酸酯(一种高强材料,可用于制作防弹窗户)。写出此合成反应的化学方程式:_________________________ 。

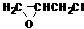
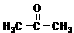

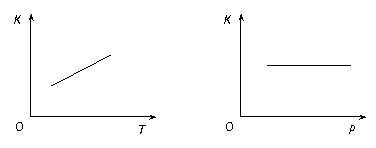
 2CO(g)+O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器(起始时的容器体积为1L)中充入一定量的CO2、CO、O2混合气体,要使容器中的反应开始时向CO2分解的方向移动,则起始时充入的三种气体的物质的量应满足的关系是
。当该反应在25℃时达到平衡后,其它条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、压强(P)变化而变化的示意图:
2CO(g)+O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器(起始时的容器体积为1L)中充入一定量的CO2、CO、O2混合气体,要使容器中的反应开始时向CO2分解的方向移动,则起始时充入的三种气体的物质的量应满足的关系是
。当该反应在25℃时达到平衡后,其它条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、压强(P)变化而变化的示意图:
 请回答下列问题:
请回答下列问题: