25.(14)某校活动小组用下图所示装置及所给药品(图中夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知C中的浓硫酸含溶质m mol,浓硫酸易和SO3形成H2SO4. SO3 , 假设气体进入C和D时分别被完全吸收,且忽略装置内空气中的CO2。
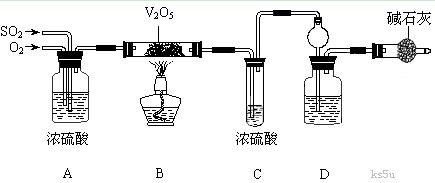
请回答下列问题:
(1)已知0.5 mol SO2被O2氧化成气态SO3,放出49.15 kJ热量,反应的热化学方程式为______________________________________________。
(2)检查完装置的气密性,加入药品开始实验,此时首先应进行的操作是________________。
(3)实验时A中氧气导管冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是 ;装置C中浓硫酸的作用为 ;装置D中盛放的溶液是足量的 (选填字母)。
a. BaCl2溶液 b. NaOH溶液 c. NaHSO3饱和溶液
(4)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是 。
26(12) 已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一氧化还原反应的体系中,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该氧化还原反应的体系中,还原剂是______,化合价没有发生变化的反应物是___ 。
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平):
________________________________________________________。
(3)上述反应中,1 mol氧化剂在反应中转移的电子为_______ mol。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变为紫红色,BiO3-反应后变为无色的Bi3证明NaBiO3的一个性质是:_______________________________________。