10、(盐城市2008/2009学年度高三年级第一次调研)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素,与实际元素符号无关。
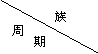 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
1 |
A |
|
|
|
|
|
|
|
2 |
B |
C |
D |
E |
J |
K |
L |
|
3 |
F |
G |
H |
I |
|
|
|
|
4 |
M |
|
|
|
|
|
|
(1)下列说法正确的是 。
A.第一电离能:A>B>E>J>K B.电负性:B>C>D>E>J
C.原子半径:F>G>H>E D.1分别与L形成的简单分子均为非极性分子
(2)表中A与E可形成A2E=E=EA2分子,有关该分子的说法不正确的是 。
A.分子中有6个σ键和2个7π键 B.三个E原子都是sp2杂化
C.四个A原子不在同一平面内 D.三个E原子在同一条直线上
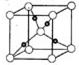
(3)F晶体的晶胞结构如右图,它的空间利用率为: (选填:52%、68%、74%)。
(4)字母K表示的元素原子基态时的价电子轨道排布式为: 。
(5)MAL2化合物中包含的微粒间作用力有: (用下列序号填写)。
 ①离子键②极性键③氢键④分子间作用力⑤金属键
①离子键②极性键③氢键④分子间作用力⑤金属键
(6)BHA4是一种络合物,中心原子配位数为: ,根据价层电子互斥理论可确定该物质中阴离子空间构型为 。
江苏省东台市五烈镇中学2010届高三化学周练
3、(2008·南通三模)1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
|
晶体 |
NaCl |
KCl |
CaO |
|
晶格能/(kJ·mol-1) |
786 |
715 |
3 401 |
4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是 。
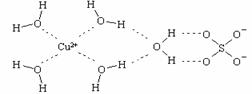 (2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示。
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示。
①写出基态Cu原子的核外电子排布式 ;金属铜采用下列 (填字母代号)堆积方式。




A B C D
②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来) 。
③水分子间存在氢键,请你列举两点事实说明氢键对水的性质的影响 。
④SO42-的空间构型是 。
 II.在Ti的化合物中,可以呈现+2、+3、+4三种化合价,
II.在Ti的化合物中,可以呈现+2、+3、+4三种化合价, Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
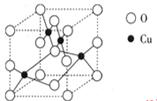 (2009·广东高考)铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(2009·广东高考)铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。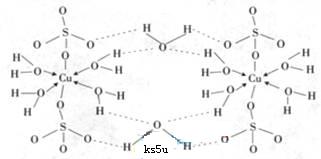
 ①甲醇的沸点比甲醛的高,其主要原因是 ;甲醛分子中碳原子轨道的杂化类型为
。
①甲醇的沸点比甲醛的高,其主要原因是 ;甲醛分子中碳原子轨道的杂化类型为
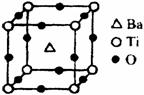
。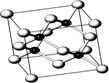 (2008·盐城三调)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,已知砷化镓的晶胞结构如右图。试回答下列问题
(2008·盐城三调)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,已知砷化镓的晶胞结构如右图。试回答下列问题