21.(《物质结构与性质》)
(1)金属镁有许多重要的用途,法国化学家维多克·格利雅因发明了在有机合成方面用途广泛的格利雅试剂而荣获诺贝尔化学奖,格利雅试剂的结构简式可表示为RMgX,它是金属镁和卤代烃反应的产物,简称格氏试剂,它在醚的稀溶液中以单体形式存在,并与二分子醚络合,在浓溶液中以二聚体存在,结构如下图:
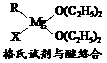
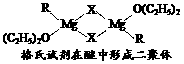
①上述2种结构中均存在配位键,把你认为是配位键的用“→”标出。
②由原子间的成键特点,可以预测中心原子Mg的杂化类型可能为_________;Mg
原子的核外电子排布式可表示为________________________。
③下列比较中正确的是_________________________________
A.金属键的强弱:Mg>Al B.基态原子第一电离能:Mg>Al
C.金属性:Mg>Al D.晶格能:NaCl>MgCl2
|
TiCl4+2Mg=======Ti+2MgCl2
①Ti元素在元素周期表中的位置是 ,钛原子的外围电子排布式为 。
②TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl4属于 (填“原子”、“分子”或“离子”)晶体。
③二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是 。
A. 苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
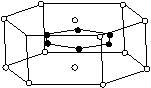 (3)2001年报导的硼和镁形成的化合物刷新了金属化合物超导温度的最高纪录。下图中示意的该化合物的晶体结构单元:镁原子间形成正六棱柱,则棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内,则该化合物的化学式可表示为
(3)2001年报导的硼和镁形成的化合物刷新了金属化合物超导温度的最高纪录。下图中示意的该化合物的晶体结构单元:镁原子间形成正六棱柱,则棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内,则该化合物的化学式可表示为
A.MgB B.MgB2 C.Mg2B D.Mg3B2
18.(10分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价Cr的强氧化性,其毒性是+3价Cr毒性的100倍。因此,必须对含铬的废水进行处理。目前研究和采用的处理方法主要有:
 方法一、还原法:在酸性介质中用FeSO4、NaHSO3等将+6价Cr还原成+3价Cr。具体流程如下:
方法一、还原法:在酸性介质中用FeSO4、NaHSO3等将+6价Cr还原成+3价Cr。具体流程如下:
有关离子完全沉淀的p H如下表。
|
|
Fe(OH)2 |
Fe(OH)3 |
Cr(OH)3 |
|
Ksp |
8.0×10-16 |
4.0×10-38 |
6.0×10-31 |
|
完全沉淀的pH |
9.0 |
3.2 |
5.6 |
请回答下列问题:
(1)在②中调节pH的范围至 为最好。(填序号)
A.3-4 B.6-8 C.10-11 D.12-14
(2)若在①使FeSO4适当过量、空气适量,使Fe2+与Fe3+的比例恰当时,可产生具有磁性、组成类似于Fe3O4•xH2O的铁氧体悬浮物,变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。
方法二、电解法:将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3十在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(3)写出此阴极反应的电极方程式 。现用上法处理1×104 L含铬(+6价)78 mg / L的废水,电解时阳极物质消耗的质量至少为________kg。
 请按要求回答:
请按要求回答: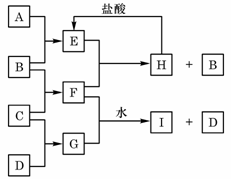 A、B、C、D是按原子序数由小到大排列的第二、
A、B、C、D是按原子序数由小到大排列的第二、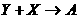 (气),
(气),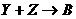 (气)。请针对以下两种不同情况回答:
(气)。请针对以下两种不同情况回答: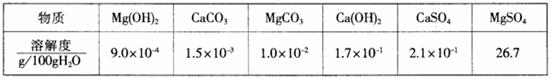
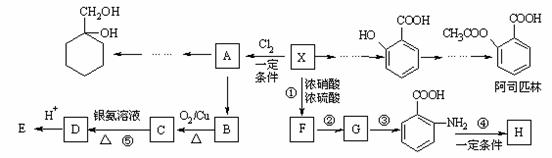
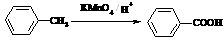
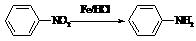 (苯胺,易被氧化)
(苯胺,易被氧化)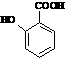 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有_____种;
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有_____种;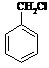 和其他无机物合成
和其他无机物合成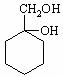 最合理的方案(不超过4步)。
最合理的方案(不超过4步)。 例:
例: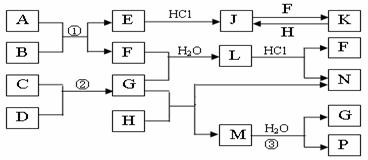
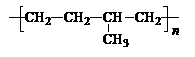 )因柔韧性好而被用于制造汽车门窗密封胶条,工业生产乙丙橡胶的单体是
。
)因柔韧性好而被用于制造汽车门窗密封胶条,工业生产乙丙橡胶的单体是
。