17.(16分)短周期主族元素X、Y、Z、W的原子序数依次增大,其中X、Y、Z位于不同周期,Y是形成化合物种类最多的元素,W2+与Ne原子具有相同的电子层结构。
⑴ 由X、Y组成的最简单化合物可作某一燃料电池的____极反应物。
⑵ Z与氧组成的某种化合物可作为潜水员的供氧剂,该化合物中含有的化学键是__。
⑶ 即热饭盒中,有W的单质与铁粉、固体食盐组成混合物A,使用时将水加入A中,几分钟后饭菜变热了。从能量转化角度看,该过程是化学能转化为____能。写出W与水反应的化学方程式:_______________________。
⑷ 500℃时,密闭容器中充入1 mol/L CO2和3 mol/L H2发生反应:
CO2(g)+3H2(g)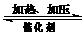 CH3OH(g)+H2O(g),测得有关数据如下:
CH3OH(g)+H2O(g),测得有关数据如下:
|
反应时间/min |
3 |
5 |
7 |
10 |
13 |
|
c(CO2)/mol·L-1 |
0.50 |
0.37 |
0.30 |
0.25 |
0.25 |
500℃时该反应的平衡常数K=____(保留一位小数),平衡时CO2的转化率为_____,温度升高,K值增大,则正反应为____热反应(填“吸”或“放”)。
⑸ 已知:298K时,Ca(s)=Ca2+(g)+2e- △H=+1807 kJ/mol
1/2O2(g)+2e-=O2―(g) △H=+986 kJ/mol
Ca2+(g)+O2―(g)=CaO(s) △H=-3528.5 kJ/mol
298K时,金属钙和氧气反应生成CaO固体的热化学方程式为_________。
 所含有的中子数目为2NA
所含有的中子数目为2NA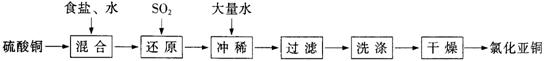
 CuCl↓+Cl―。
CuCl↓+Cl―。
 ②
② ③
③ ④
④ ⑤
⑤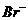 ⑥
⑥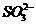 ⑦
⑦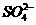 离子中的若干种(忽略水电离出的
离子中的若干种(忽略水电离出的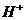 、
、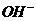 ),依次进行下列实验,且每步所加试剂均过量,观察到的现象如下。
),依次进行下列实验,且每步所加试剂均过量,观察到的现象如下。
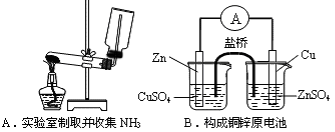

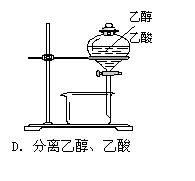 下列装置或操作能达到实验目的的是
( )
下列装置或操作能达到实验目的的是
( )