10.(15分)硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。
[提出问题]Na2S2O3是否与Na2SO4相似从而具备下列性质呢?
猜想①: ;
猜想②:溶液呈中性,且不与酸反应;
猜想③:无还原性,不能被氧化剂氧化。
[实验探究]基于上述猜想②、③,设计实验方案。
|
|
实验操作 |
实验现象或预期实验现象 |
现象解释(用离子方程式表示) |
|
|
A.
|
溶液pH=8 |
|
|
猜想② |
向pH=2的硫酸中滴加Na2S2O3溶液 |
B.
|
S2O32-+2H+==S↓+S02↑+H2O |
|
猜想③ |
向新制氯水(pH<2)中滴加少量Na2S2O3溶液 |
氯水颜色变浅 |
C.
|
[实验结论]Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
[问题讨论]
(1)甲同学向“探究‘猜想③’”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由
。
(2)请重新设计一个实验方案,证明Na2S2O3被氯水氧化。该实验方案是
。
选考部分
8.(16分)原子序数递增的部分短周期主族元素的原子半径数据如下表:
|
元素 |
A |
B |
D |
E |
F |
G |
M |
N |
P |
|
原子半径/
nm |
0.077 |
0.070 |
0.066 |
0.064 |
0.186 |
0.160 |
0.143 |
0.104 |
0.099 |
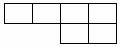 (1)已知A、B、D、E、N、P为非金属元素,且均不与F、G、M中的任何一种元素同族,在周期表中的相对位置如下,请将相应元素符号填在表中。
(1)已知A、B、D、E、N、P为非金属元素,且均不与F、G、M中的任何一种元素同族,在周期表中的相对位置如下,请将相应元素符号填在表中。
(2)B在周期表中的位置为 ;
AD2的电子式为 。
(3)M的最高价氧化物的水化物是胃药“胃舒平”的主要成分,可以治疗胃酸过多,反应的离子方程式为 。
(4)AD2与ND2性质相似,G在ND2中也可以剧烈燃烧,可能的产物是 ,反应的化学方程式为 。
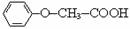 )
) ,
,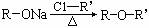 (R-、
(R-、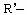 代表烃基)
代表烃基)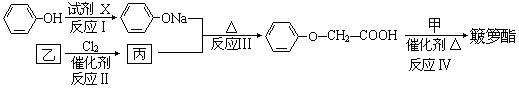
 (14分)一定条件下铁可以和CO2发生反应:
(14分)一定条件下铁可以和CO2发生反应: FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0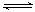 KI3(KI3易溶于水)。下列推断错误的是( )。
KI3(KI3易溶于水)。下列推断错误的是( )。