24.(13分)摩尔盐[(NH4)2SO4·FeSO4·6H2O]是浅蓝色晶体,在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂。某研究性学习小组设计了下面的实验装置来制备摩尔盐。
实验步骤:
①把30%NaOH溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的NaOH溶液装入F中。
②在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4。
③将硫酸亚铁溶液与硫酸铵溶液混合,经过一定的操作得到摩尔盐晶体。
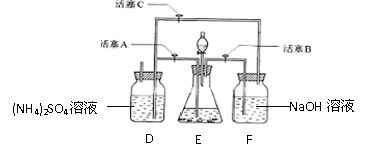
试回答下列问题:
(1)实验步骤①的目的是 ▲ ;实验中替代NaOH溶液的常用试剂是 ▲ ;
(2)Fe屑和稀H2SO4反应产生的氢气可赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,操作时应先关闭活塞 ▲ ,并同时打开活塞 ▲ ;
请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用 ▲ ;
(3)下表为硫酸亚铁、硫酸铵、硫酸亚铁铵在水中溶解度(单位:g/100g水)
|
温度(℃) 物质 |
10 |
20 |
30 |
70 |
|
FeSO4 |
20.5 |
26.6 |
33.2 |
56.0 |
|
(NH4)2SO4 |
73.0 |
75.4 |
78.1 |
91.9 |
|
(NH4)2SO4·FeSO4·6H2O |
18.1 |
21.2 |
24.5 |
38.5 |
则步骤③中分离并得到纯净硫酸亚铁铵晶体的操作方法是浓缩结晶、 ▲ 、 ▲ 、干燥。
(4)测定摩尔盐的含量:
制得的硫酸亚铁铵晶体中往往含有极少量的Fe3+。为测定晶体中Fe2+的含量,称取一份质量为20.0 g的硫酸亚铁铵晶体样品,制成溶液。用0.5 mo1.L-1 KMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO-4被还原成Mn2+时,耗KMnO4溶液体积20.00mL。 滴定时,将KMnO4溶液装在 ▲ (酸式或碱式)滴定管中,判断反应到达滴定终点的现象为 ▲ ;晶体中FeSO4的质量分数为 ▲ 。
衢州一中2009学年度第一学期高三期中试卷
化学答题卷
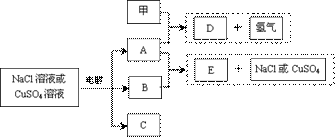
 回答下列问题:
(1)甲元素的原子结构示意图是 ▲ ;
(2)若电解的是NaCl溶液:
①A与B反应的离子方程式是 ▲ ;
②若电解100mL0.02mol•L-1NaCl溶液,阴、阳两极各产生11.2mL气体(标准状况),则所得溶液的pH为 ▲ (忽略反应前后溶液的体积变化)
(3)若电解的是CuSO4溶液:
①E的化学式是 ▲ ;电解时阳极的电极反应式是 ▲ ;
②加热时,A的浓溶液可与B发生反应,A的浓度随时间变化的图像正确是 ▲ ;
回答下列问题:
(1)甲元素的原子结构示意图是 ▲ ;
(2)若电解的是NaCl溶液:
①A与B反应的离子方程式是 ▲ ;
②若电解100mL0.02mol•L-1NaCl溶液,阴、阳两极各产生11.2mL气体(标准状况),则所得溶液的pH为 ▲ (忽略反应前后溶液的体积变化)
(3)若电解的是CuSO4溶液:
①E的化学式是 ▲ ;电解时阳极的电极反应式是 ▲ ;
②加热时,A的浓溶液可与B发生反应,A的浓度随时间变化的图像正确是 ▲ ;
 (9分)在773 K、固定体积的容器中,反应CO(g)+2H2(g)
(9分)在773 K、固定体积的容器中,反应CO(g)+2H2(g) CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
(1) 若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为 ▲ ;
(2) 在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可) ▲
、 ▲ ;
(3) 某温度下,在容积为10L的容器中,若投入1mol CO和3mol H2,平衡时CO的转化率为60%,则反应的平衡常数K为 ▲ ;
CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
(1) 若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为 ▲ ;
(2) 在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可) ▲
、 ▲ ;
(3) 某温度下,在容积为10L的容器中,若投入1mol CO和3mol H2,平衡时CO的转化率为60%,则反应的平衡常数K为 ▲ ;  在密闭容器中进行反应2SO2+O2
在密闭容器中进行反应2SO2+O2